Estrutura de cloreto de mercúrio (ii), propriedades, obtenção, uso

- 4762
- 871
- Shawn Leffler
Ele Cloreto de Mercúrio (II) É um composto inorgânico formado por um átomo do metal mercúrio (Hg) e dois átomos do halogênio do cloro (CL). Mercúrio está em seu estado de oxidação +2 e cloro -1.
Sua fórmula química é HGCL2. É um sólido cristalino ligeiramente volátil à temperatura ambiente. Os sindicatos entre seus átomos são mais covalentes do que iônicos.
 Cloreto de Mercúrio (II). MrGreen71/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons.
Cloreto de Mercúrio (II). MrGreen71/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0). Fonte: Wikimedia Commons. Ao se dissolver na água, mantém sua estrutura molecular. Também é solúvel em vários solventes orgânicos. Pela luz da luz, tende a formar mercúrio metálico.
No passado, era usado como anti -séptico e para tratar certas doenças infecciosas, tanto em humanos quanto em animais. Também como inseticida para controlar pragas, como formigas e cupins.
No entanto, quando sua alta toxicidade é verificada, a maioria desses usos foi abandonada e atualmente é usada apenas em laboratórios de química ou análise bioquímica.
Pode explorar sob certas condições. É um composto venenoso, causa danos a humanos, animais e plantas. Nunca deve ser descartado para o meio ambiente. Também é suspeito de ser carcinogênio.
[TOC]
Estrutura
O cloreto de mercúrio é composto de HG em oxidação II e cloro com Valência -1. Neste haluro, os vínculos entre os átomos têm um caráter covalente muito acentuado.
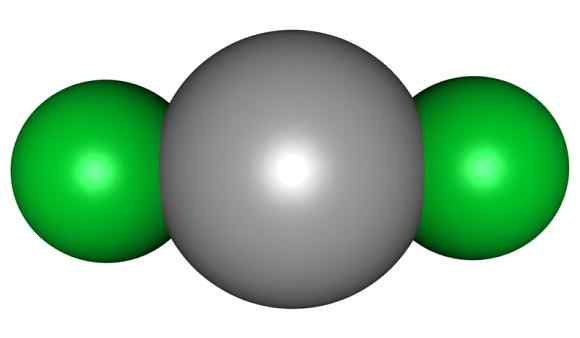 Molécula HGCL2. Cinza = mercúrio; Verde = cloro. Arrowsmaster / Domínio Público. Fonte: Wikimedia Commons.
Molécula HGCL2. Cinza = mercúrio; Verde = cloro. Arrowsmaster / Domínio Público. Fonte: Wikimedia Commons. Isso significa que no vidro o composto mantém sua estrutura molecular Cl-HG-CL, onde a distância Hg-Cl é semelhante a quando está em um estado gasoso, enquanto no vidro a distância com os átomos de cloro de outras moléculas é muito idoso.
 Arranjo de moléculas HGCL2 No vidro. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Arranjo de moléculas HGCL2 No vidro. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. No estado gasoso, é claramente molecular e também em solução aquosa.
Nomenclatura
- Cloreto de Mercúrio (II)
- Cloreto mercúrico
- Bicloreto de Mercúrio
- Dicloromercurio
Propriedades
Estado físico
Cristais brancos e cristalinos cristalinos, rombic.
 Cloreto mercúrico sólido. LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Cloreto mercúrico sólido. LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Peso molecular
271,5 g/mol
Ponto de fusão
280 ºC
Ponto de sublimação
A 300 ° C sublima, isto é, vai diretamente do sólido a gás.
Densidade
5,6 g/cm3
Solubilidade
Pequena água solúvel: 7,31 g/100 ml a 25 ° C. Solúvel em álcool: 33 g/ 100 ml a 25 ° C. Solúvel em acetato de etila. Pouco solúvel em éter: 4 g/100 ml. Algo solúvel em benzeno.
Pode servir a você: Helmholtz Livre Energy: Units, como é calculado, exercícios resolvidosph
Uma solução de 0,2 moles/l tem um pH de 3,2-4,7.
Propriedades quimicas
Em solução aquosa, existe quase exclusivamente (± 99%) na forma de uma molécula HGCL2. No entanto, sofre alguma hidrólise:
Hgcl2 + H2Ou ⇔ hg (oh) cl + h+ + Cl-
Hgcl2 + 2 h2Ou ⇔ hg (oh)2 + 2 h+ + 2 Cl-,
Apresenta uma solubilidade acentuada em solventes orgânicos, onde assume a forma de dímeros, ou seja, duas moléculas ligadas.
Na presença de matéria orgânica e por ação da luz solar, é reduzida a formação de cloreto de mercúrio (i) (HGCL) e depois o Mercúrio Metálico.
Hgcl2 + Luz solar → hgcl → hg0
Com a solução de hidróxido de sódio (NaOH), gera um precipitado amarelo amarelo (HGO).
É incompatível ou reage com formas, sulfitos, fosfatos, sulfídios, gelatina, albumina, álcalis, amônia, hidróxido de cálcio, brometos, carbonatos, ferro, cobre, chumbo, sais de prata e alguns materiais vegetais.
Outras propriedades
Devido, entre outras coisas, com seu caráter mais covalente que iônico, é ligeiramente volátil à temperatura ambiente e é consideravelmente volatilizado a 100 ° C.
Obtenção
Você pode preparar o Mercúrio Metálico Oxidante (HG0) com gás de cloro (CL2). Ao aquecer e atingir mais de 300 ° C, uma chama aparece e um vapor coletado é sublimado e quando os cristais HGCL são formados2.
Hg + cl2 + Calor → hgcl2
Também é obtido pelo aquecimento do sulfato de mercúrio (II) seco com cloreto de sódio. Vapores HGCL2 que subliman são coletados e condensados a um sólido cristalino.
Hgso4 + 2 NACL → HGCL2 + N / D2SW4
A reação entre óxido de mercúrio (II) com ácido clorídrico em quantidades estequiométricas produz cristais HGCL2 Quando o meio é resfriado.
HGO + 2 HCl → HGCL2 + H2QUALQUER
Os cristais podem ser purificados por recristalização e sublimação.
Formulários
Em Laboratórios Químicos
É usado como reagente em várias análises químicas. Permite a preparação de outros compostos de mercúrio, como iodeto de mercúrio (II), óxido de mercúrio (II), cloreto de mercúrio (i), cloreto de amônio e mercúrio (II).
Pode atendê -lo: fluoreto: história, propriedades, estrutura, obtenção, riscos, usosEm Pathology Laboratories
Faz parte da solução acética de Zenker, que é usada para tratar amostras ou espécimes de biópsias de medula óssea. Os tecidos são rapidamente definidos com excelentes detalhes histológicos a serem observados com o microscópio.
 Às vezes hgcl2 É usado em laboratórios de patologia. Autor: Ernesto Eslava. Fonte: Pixabay.
Às vezes hgcl2 É usado em laboratórios de patologia. Autor: Ernesto Eslava. Fonte: Pixabay. Usos abandonados
Nos tempos medievais e até o início do xx, ele era usado em várias aplicações, pois seu efeito prejudicial para a saúde era desconhecido.
- Como tratamento de certas doenças, anti -séptico e desinfetante tópicos.
 No passado HGCL2 Foi usado para tratar a sífilis. G. H. Raposa / domínio público. Fonte: Wikimedia Commons.
No passado HGCL2 Foi usado para tratar a sífilis. G. H. Raposa / domínio público. Fonte: Wikimedia Commons. - Na medicina veterinária como um agente cáustico, desinfetante e anti -séptico.
- Na agricultura, ele atuou como fungicida, para controlar os vermes terrestres, como inseticida e repelente de baratas, formigas e cupins, e como desinfetante para proteger sementes e lâmpadas.
- Para conservação de madeira, o agente químico para embalsam e conservar amostras anatômicas.
- Como catalisador na obtenção de cloreto de vinil de acetileno.
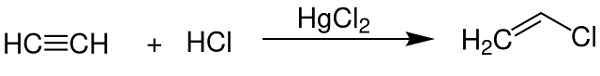 O cloreto de mercúrio (II) serve como um catalisador para obter alguns compostos químicos. Chem Sim 2001 / Domínio Público. Fonte: Wikimedia Commons.
O cloreto de mercúrio (II) serve como um catalisador para obter alguns compostos químicos. Chem Sim 2001 / Domínio Público. Fonte: Wikimedia Commons. - No eletrodo de alumínio.
- Para marcar ferro e aço.
- Como reagente fotográfico.
- Na impressão de tecidos, como mordente por coelho e pêlo de mamona, para corante de madeira.
- Como um componente de baterias secas.
Riscos
Para a saúde
É um composto corrosivo e extremamente tóxico se for ingerido, pois pode causar morte. Ataca o trato gastrointestinal e o sistema renal. Causar queimaduras graves na pele e olhos.
Exposição prolongada ou repetida a este composto causa danos aos órgãos internos. Todas as formas de mercúrio são venenosas e o HGCL2 é um dos mais tóxicos.
Suspeita -se que seja carcinogênio, o que causa defeitos genéticos e danos à fertilidade.
Perigo de incêndio
Embora não seja o combustível possa explodir ao aplicar calor. Quando quebra gases tóxicos e tóxicos de mercúrio.
Misturas HGCL2 Com metais alcalinos, como sódio ou potássio, eles são muito sensíveis a golpes e podem explorar com os impactos. Se você entrar em contato com amônia, sulfetos, ácido oxálico e acetileno também podem explodir.
Pode atendê -lo: ácido clorídrico (HCl)Efeitos no meio ambiente
É muito tóxico para os organismos aquáticos e terrestres, seus efeitos duram ao longo do tempo. Pode apresentar bioacumulação em toda a cadeia alimentar, tanto em plantas quanto em animais.
 O cloreto mercúrico nunca deve ser descartado no meio ambiente. Autor: Naadjuuh. Fonte: Wikimedia Commons.
O cloreto mercúrico nunca deve ser descartado no meio ambiente. Autor: Naadjuuh. Fonte: Wikimedia Commons. Afeta a respiração, a fotossíntese e outros caminhos metabólicos das plantas causando sua deterioração. Sua disposição no meio ambiente (nem água nem solos nem atmosfera) não devem ser afetados).
Presença perigosa em alguns remédios naturais
Apesar de sua toxicidade, existem remédios e ervas naturais que o contêm, então as pessoas, sem saber, são perigosamente expostas a este composto.
Por exemplo, na medicina tradicional Chinese Calomel ou Qing Fen contém algum HGCL2. É um remédio usado como diurético, anti -séptico, pomada de pele, laxante e aplicada externamente para desconforto de dentição em crianças.
 Alguns medicamentos naturais controlados pela ONU podem conter HGCL2. Autor: Silvija Seres. Fonte: Pixabay.
Alguns medicamentos naturais controlados pela ONU podem conter HGCL2. Autor: Silvija Seres. Fonte: Pixabay. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Cloreto mercúrico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Lester, s.C. (2010). Processamento de amostra. O fixador acético de Zenker (laranja). Em Manual de Patologia Cirúrgica (terceira edição). Recuperado de cientedirect.com.
- Clarksson, t.C. (2001). Agentes. Propriedades físicas e químicas. No Manual de Toxicologia Peticid (segunda edição). Recuperado de cientedirect.com.
- Fretham, s.J.B. et al. (2015). Mercúrio e neurodegeneração. Remédios naturais e ervas contendo HG. Em nutracêuticos bioativos e suplementos alimentares em doenças neurógicas e cerebrais. Recuperado de cientedirect.com.
- Cavaleiro, s. et al. (2014). Distribuição e abundância de plantas aquáticas - impactos humanos. Poluentes químicos. Na modulação de referência em sistemas terrestres e ciências do ambiente. Recuperado de cientedirect.com.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Ciavatta, l. e Grimaldi, M. (1968). A hidrólise do cloreto de mercúrio (II), HGCL2. Jornal de Química Inorgânica e Nuclear, Volume 30, Edição 2, fevereiro de 1968, páginas 563-581. Recuperado de cientedirect.com.
- Fundação Wikimedia (2020). Mercúrio (II) Cloreto. Recuperado de.Wikipedia.org.
- « 21 cientistas mexicanos e suas contribuições históricas
- Mercúrio fulminar estrutura, propriedades, obtenção, usos »

