Fosfato de magnésio (Mg3 (PO4) 2)
- 1610
- 395
- Ernesto Bruen
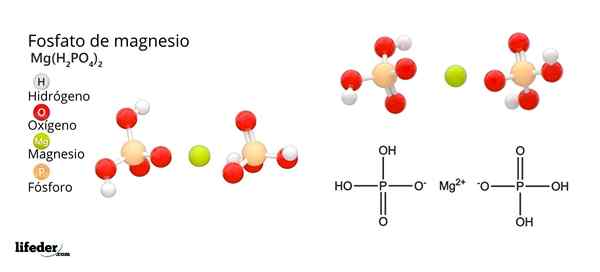
 Estrutura e fórmula de fosfato de magnésio
Estrutura e fórmula de fosfato de magnésio O que é fosfato de magnésio?
Ele Fosfato de magnésio É um termo usado para se referir a uma família de compostos inorgânicos formados por magnésio, metal alcalino e oxoanion de fosfato. O fosfato de magnésio mais simples tem uma fórmula química MG3(Po4)2. A fórmula indica que para cada dois ânions43- Existem três cátions mg2+ interagindo com estes.
Além disso, esses compostos podem ser descritos como sais de magnésio derivados do ácido ortofosfáhico (H3Po4). Em outras palavras, o magnésio é "coletado" entre ânions fosfato, independentemente de sua apresentação inorgânica ou orgânica (MGO, MG (não3)2, Mgcl2, Mg (oh)2, etc.).
Por esses motivos, os fosfatos de magnésio podem ser encontrados como vários minerais. Alguns deles são: catteite -mg3(Po4)2 · 22h2O-, struvita -(NH4) MGPO4· 6h2Ou, cujos microcristais são representados na imagem superior, holdedalita -mg2(Po4) (Oh) - e Bobierrite -mg3(Po4)2· 8h2QUALQUER-.
No caso do Bobierrite, sua estrutura cristalina é monoclínica, com agregados cristalinos com fãs e rosetas maciços. No entanto, os fosfatos de magnésio são caracterizados por exibir um químico estrutural rico, o que significa que seus íons adotam muitos arranjos cristalinos.
Formas de fosfato de magnésio e neutralidade de suas cargas
Os fosfatos de magnésio derivam da substituição de prótons H3Po4. Quando o ácido ortofosfórico perde um próton, permanece como o íon fosfato di -hidrogênio2Po4-.
Como neutralizar a carga negativa para causar um sal de magnésio? Sim mg2+ Responsável por duas cobranças positivas e depois precisa de dois h2Po4-. Assim, é obtido fosfato de diácido de magnésio2Po4)2.
Então, quando o ácido perde dois prótons, o íon hidrogenfosfato permanece, HPO42-. Agora como neutralizar essas duas cargas negativas? Como o MG2+ Você só precisa de duas cargas negativas para neutralizar, interagir com um único íon hpo42-. Dessa maneira, é obtido fosfato de ácido de magnésio: mghpo4.
Pode atendê -lo: óxido de magnésio: estrutura, propriedades, nomenclatura, usosFinalmente, quando todos os prótons são perdidos, o ânion fosfato permanece43-. Isso requer três cátions mg2+ e de outro fosfato para montar em um sólido cristalino. Equação matemática 2 (-3) + 3 (+2) = 0 ajuda a entender essas proporções estequiométricas para magnésio e fosfato.
Como resultado dessas interações, é produzido fosfato de magnésio tribásico: MG3(Po4)2. Por que é tribásico? Porque ele é capaz de aceitar três h equivalentes+ Para formar o H novamente3Po4:
Po43-(AC) + 3h+(AC) H3Po4(AC)
Fosfatos de magnésio com outros cátions
A compensação de cargas negativas também pode ser alcançada com a participação de outras espécies positivas.
Por exemplo, para neutralizar o PO43-, Os íons k+, N / D+, Rb+, NH4+, etc., Eles também podem interceder, formando composto (x) mgpo4. Se x for igual a NH4+, O mineral de estruvita anidro é formado (NH4) MGPO4.
Dar. Graças a isso, numerosos cristais de fosfato de magnésio podem ser sintetizados (NA3Rbmg7(Po4)6, por exemplo).
Estrutura

A imagem superior ilustra as interações entre os íons MG2+ e Po43- que definem a estrutura cristalina. No entanto, é apenas uma imagem que demonstra bastante a geometria tetraédrica de fosfatos. Então, a estrutura cristalina implica fosfato e esferas de magnésio tetraedros.
No caso de MG3(Po4)2 anidro, os íons adotam uma estrutura romboédrica, na qual o mg2+ é coordenado com seis átomos de O.
O acima é ilustrado na imagem inferior, com a dimensão de que as esferas azuis são cobalto, apenas alterando -as para as esferas verdes do magnésio:
Pode servir a você: ligas não ferrosas: estrutura, propriedades, usos, exemplos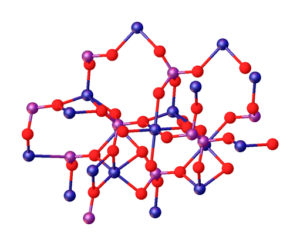
Apenas no centro da estrutura, Octaedro formado pelas seis esferas vermelhas ao redor da esfera azulada pode ser localizada.
Além disso, essas estruturas cristalinas são capazes de aceitar moléculas de água, formando hidratos de fosfato de magnésio.
Isso ocorre porque eles formam pontes de hidrogênio com íons fosfato (Hoh-o-PO33-). Além disso, cada íon fosfato é capaz de aceitar até quatro pontes de hidrogênio; isto é, quatro moléculas de água.
Como o MG3(Po4)2 Possui dois fosfatos, pode aceitar oito moléculas de água (que acontecem com o mineral de Bobierrite). Por sua vez, essas moléculas de água podem formar pontes de hidrogênio com outras pessoas ou interagir com os centros MG positivos2+.
Propriedades
É um sólido branco, formando placas rômbicas cristalinas. Também não tem cheiro e sabor.
É muito insolúvel em água, mesmo quando está quente, devido à sua grande energia de rede cristalina; Este é o produto das fortes interações eletrostáticas entre os íons versáteis MG2+ e Po43-.
Ou seja, quando os íons são versáteis e seus rádios iônicos não variam muito em tamanho, o sólido mostra resistência à sua dissolução.
Derrete a 1184 ºC, o que também é indicativo das fortes interações eletrostáticas. Essas propriedades variam dependendo de quantas moléculas de absorver água e se o fosfato estiver em algumas de suas formas protonadas (HPO42- ou h2Po4-).
Usa/aplicações
Laxante
Foi usado como laxante para estados de constipação e acidez gástrica. No entanto, seus efeitos colaterais prejudiciais - manifestados pela geração de diarréia e vômito - limitaram seus usos. Além disso, é provável que produza danos ao trato gastrointestinal.
Pode atendê -lo: oxigênio molecular: estrutura, propriedades, usosReparo de ossos
O uso de fosfato de magnésio no reparo do tecido ósseo está atualmente sendo explorado, investigando a aplicação do MG (H2Po4)2 como cimento.
Esta forma de fosfato de magnésio atende aos requisitos para isso: é biodegradável e histocompatível. Além disso, seu uso na regeneração do tecido ósseo é recomendado para sua resistência e configuração rápida.
Material para ortopedia
O uso de fosfato de magnésio amorfo (AMP) está sendo avaliado como cimento ortopédico biodegradável e não exexotérmico. Para gerar esse cimento, o amplificador em pó com álcool polivinílico é misturado, a fim de formar uma massa.
Em seres vivos
A principal função do fosfato de magnésio é servir como uma contribuição para os seres vivos. Esse elemento intervém em inúmeras reações enzimáticas, como catalisador ou intermediário, sendo essencial para a vida.
Uma deficiência de MG em humanos está associada aos seguintes efeitos: diminuição nos níveis de Ca, insuficiência cardíaca, retenção de Na, diminuição dos níveis de K, arritmias, contrações musculares sustentadas, vômito, náusea, baixos níveis circulantes de hormônio da paratireóide e estômago e cãibras menstruais, entre outros.
Referências
- Publicação de dados minerais. (2001-2005). Bobierrite. Recuperado do manual de mineralogia.org
- Sahar Mousa. (2010). Estudo sobre a síntese de materiais de fosfato de magnésio. Boletim de pesquisa de fósforo vol. 24, pp 16-21.
- Wikipedia. (2018). Tribásico de fosfato de magnésio. Recuperado de.Wikipedia.org
- PubChem. (2018). Fosfato de magnésio anidro. Recuperado de PubChem.NCBI.Nlm.NIH.Gov
- Barbie, e., Lin, b., Goel, v.K. E Bhaduri, S. (2016) Avaliação do cimento não exexotérmico baseado em fosfato de magnésio amorfo (AMP). Tapete biomédico. Volume 11 (5): 055010.
- Yu, e., Yu, cap. E Dai, H. (2016). Preparação de cimento ósseo de magnésio degível. Biomateriais regenerativos. Volume 4 (1): 231

