Caráter metálico
- 2037
- 207
- Alfred Kub
Qual é o personagem metálico?
Ele Caráter metálico dos elementos A tabela periódica refere -se a todas as variáveis, químicas e físicas, que definem metais ou os distinguem de outras substâncias da natureza. Eles são geralmente brilhantes, densos, duros, altos térmicos e elétricos, moldáveis e condutividades dúcteis.
No entanto, nem todos os metais exibem essas características; Por exemplo, no caso de Mercúrio, este é um líquido preto brilhante. Além disso, essas variáveis dependem das condições de pressão e temperatura terrestre. Por exemplo, aparentemente não -metálico o hidrogênio pode se comportar fisicamente como um metal em condições extremas.
Essas condições podem ser: sob pressões abismais ou temperaturas muito frias em torno do zero absoluto. Para definir se um elemento é metálico ou não, é necessário considerar padrões ocultos aos olhos do observador: padrões atômicos.
Eles discriminam mais precisão e confiabilidade quais são os elementos metálicos, e até qual elemento é mais metálico do que outro.
Dessa maneira, o verdadeiro caráter metálico de uma moeda de ouro se baseia mais nas qualidades de seus átomos do que aqueles determinados por sua massa dourada, mesmo ambos estão intimamente relacionados.
Qual das moedas é mais metálica: um de ouro, um de cobre ou platina? A resposta é platina e a explicação está em seus átomos.
Como varia o caráter metálico dos elementos na tabela periódica?
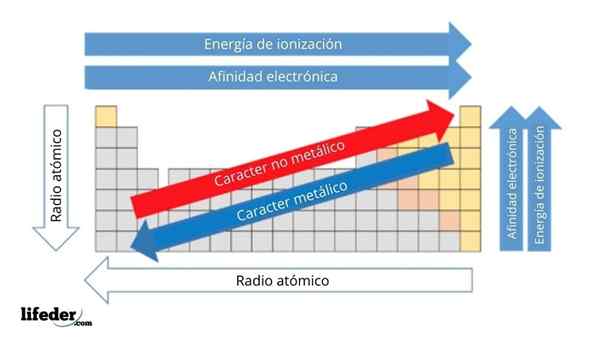
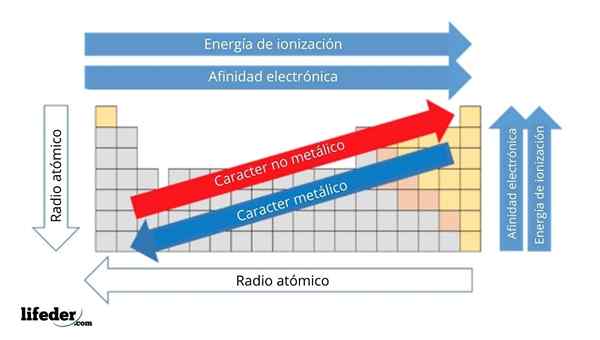
Na imagem superior, você tem as propriedades periódicas dos elementos. As linhas correspondem aos períodos e colunas para os grupos.
O caráter metálico diminui da esquerda para a direita da tabela periódica e aumenta na direção oposta. Da mesma forma, o caráter metálico aumenta de cima para baixo e diminui à medida que os períodos são percorridos para cabeças de grupo.
Pode atendê -lo: bases: características e exemplosDessa forma, os elementos que estão próximos da direção em que os pontos de seta têm maior caráter metálico do que os localizados na direção oposta (os blocos amarelos).
Além disso, as outras setas correspondem a outras propriedades periódicas, que definem em que sentido elas aumentam ou diminuem à medida que o elemento é "metálico". Por exemplo, os elementos dos blocos amarelos, embora tenham baixo caráter metálico, sua afinidade eletrônica e energia de ionização são altas.
No caso de rádios atômicos, quanto maior, mais metálico é o elemento; Isso é indicado pela seta azul.
Propriedades de elementos metálicos
Na tabela periódica, observa -se que os metais têm grandes rádios atômicos, energias de baixa ionização, baixas afinidades eletrônicas e baixas eletronegatividades. Como memorizar todas essas propriedades?
O ponto em que eles fluem é a reatividade (eletropositividade) que define metais, que oxidam; isto é, eles perdem elétrons facilmente.
Quando eles perdem elétrons, os metais formam cátions (M+). Portanto, os elementos com o caráter metálico mais alto formam cátions mais facilmente do que os de caráter metálico inferior.
Um exemplo do exposto acima é considerar a reatividade dos elementos do grupo 2, os metais alcalinotherrosos. O berílio é menos metálico que o magnésio, e isso por sua vez é menos metálico que o cálcio.
Então, até chegar ao metal Bario, o mais reativo do grupo (após o raio, elemento radioativo).
Como o raio atômico na reatividade dos metais afeta?
À medida que o raio atômico aumenta, os elétrons de Valência estão mais longe do núcleo, então eles são retidos com menos força no átomo.
Pode atendê -lo: hidróxido de sódio (NaOH): estrutura, propriedades, usos, sínteseNo entanto, se um período for perseguido para o lado direito da tabela periódica, o núcleo adiciona prótons ao seu corpo, agora mais positivo, o que atrai elétrons de valência mais fortemente, reduzindo o tamanho do raio atômico. Isso resulta em uma diminuição no caráter metálico.
Assim, um átomo muito pequeno e com um núcleo muito positivo tende a ganhar elétrons em vez de perdê -los (elementos não -metálicos), e aqueles que podem ganhar e perder elétrons são considerados metaloides. Boro, silício, Germanio e arsênico são alguns desses metalóides.
Por outro lado, o raio atômico também aumenta se houver nova disponibilidade de energia para outros orbitais, que ocorre quando descendo em um grupo.
Por esse motivo, ao descer na tabela periódica, os rádios ficam volumosos e o núcleo se torna incapaz de impedir que outras espécies arrebatem os elétrons de sua camada externa.
Em laboratório, com um forte agente oxidante, como ácido nítrico diluído (HNO3)- As reatividades metálicas diante da oxidação podem ser estudadas.
Da mesma forma, os processos de formação de seus halogenetos de metal (NACL, por exemplo) também são experimentos demonstrativos dessa reatividade.
Elemento de maior caráter metálico
 Césio
Césio A direção da seta azul na imagem da tabela periódica leva aos elementos de Frania e Cesio. O Frania é mais metálico que o césio, mas, diferentemente do último, o Frania é artificial e radioativo. Por esse motivo, o césio ocupa o lugar do elemento natural de maior caráter metálico.
Pode atendê -lo: óxido de ferroDe fato, uma das reações conhecidas mais conhecidas (e explosivas) é a que ocorre quando uma peça (ou gotas) de césio entra em contato com a água.
A alta reatividade do césio, também traduzida para a formação de compostos muito mais estáveis, é responsável pela liberação repentina de energia:
2cs (s) + 2h2O → 2csoh (aq) + h2(g)
A equação química permite ver a oxidação do césio e a redução do hidrogênio da água para hidrogênio gasoso.
Elemento de caráter metálico inferior
 Modelo de fluorina 3D
Modelo de fluorina 3D Na diagonal oposta, no canto superior direito da tabela periódica, fluoreto (f2, imagem superior) lidera a lista de elementos não -metálicos. Porque? Porque é o elemento da natureza mais eletronegativa e a que a menor energia de ionização.
Em outras palavras, ele reage com todos os elementos da tabela periódica para formar o íon f- e não f+.
É muito improvável que a fluorina perca elétrons em alguma reação química, bastante contrária a metais. É por esse motivo que é o elemento de caráter metálico inferior.
Referências
- Lúmen, química para não-majors. Caráter metálico e não metálico. Recuperado de cursos.Lumenarning.com
- Tarefa de Química. (2018). Eletroposostividade ou caráter metálico. Recuperado da assinatura química.com
- Juan Ramos. Lista completa de metais e não metais. Recuperado de sciencerends.com
- Anne Marie Helmestine, PH.D. Propriedades e tendências metálicas de caracteres. Recuperado do pensamento.com

