Elétron diferencial
- 3292
- 620
- Melvin Mueller
Ele elétron diferencial o Diferenciador é o último elétron colocado na sequência da configuração eletrônica de um átomo. Qual o seu nome? Para responder a essa pergunta, é necessário conhecer a estrutura básica de um átomo: seu núcleo, o vazio e os elétrons.
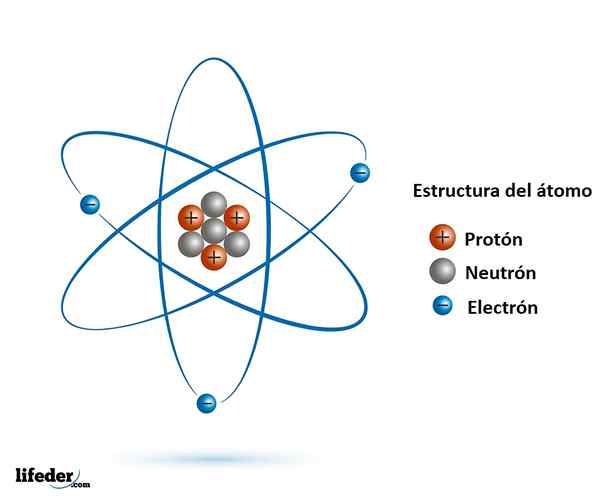
O núcleo é um agregado denso e compacto de partículas positivas chamadas prótons e partículas neutras chamadas nêutrons. Os prótons definem o número atômico Z e, juntamente com os nêutrons, compõem a massa atômica. No entanto, um átomo não pode carregar apenas cargas positivas; Portanto, os elétrons orbitam ao redor do núcleo para neutralizá -lo.
 Estrutura básica do átomo: partículas subatômicas principais
Estrutura básica do átomo: partículas subatômicas principais Assim, para cada próton que aumenta o núcleo, um novo elétron é incorporado em seus orbitais para neutralizar a crescente carga positiva. Dessa maneira, o novo elétron adicionado, o elétron diferencial, está intimamente relacionado ao número atômico Z.
O elétron diferencial é encontrado na camada eletrônica mais externa: a camada de Valência. Portanto, quanto mais o núcleo for, maior a energia associada a ele. Essa energia é responsável por sua participação, bem como a do restante dos elétrons de Valência, nas reações químicas características dos elementos.
[TOC]
Números quânticos
Assim como o restante dos elétrons, o elétron diferencial pode ser identificado por seus quatro números quânticos. Mas quais são os números quânticos? Eles são "n", "l", "m" e "s".
O número quântico "n" indica o tamanho dos níveis de átomo e energia (k, l, m, n ou, p, q). "L" é o número quântico secundário ou acremutal, que indica a forma dos orbitais atômicos, e leva valores de 0, 1, 2 e 3 para os orbitais "s", "p", "d" e "f" f " ", respectivamente.
Pode atendê -lo: Flask aforado: Características, para que serve, tipos, usos"M" é o número quântico magnético e indica a orientação espacial dos orbitais sob um campo magnético. Assim, 0 para o orbital "s"; -1, 0, +1, para o orbital "p"; -2, -1, 0, +1, +2, para o orbital "d"; e -3, -2, -1, 0, +1, +2, +3, para o orbital "f". Finalmente, o número quântico de “s” de rotação (+1/2 para ↑ e -1/2 para ↓).
Portanto, um elétron diferencial associou os números quânticos anteriores ("n", "l", "m", "s"). Como neutraliza a nova carga positiva gerada pelo próton adicional, também fornece o número atômico z do elemento.
Como saber o elétron diferencial?
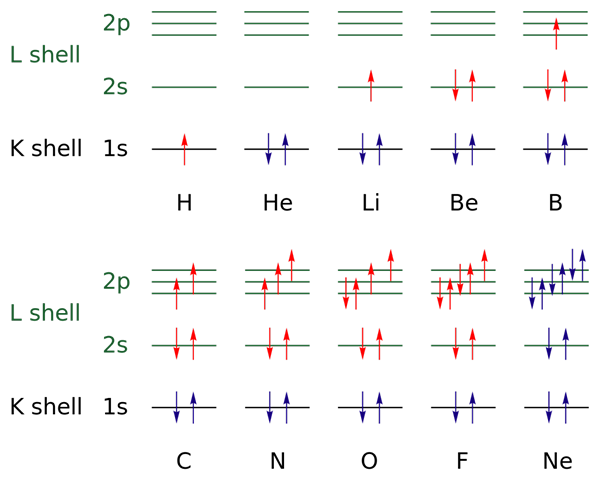
Na imagem superior, as configurações eletrônicas são representadas para os elementos do hidrogênio ao gás neon (H → NE).
Nisso, os elétrons das camadas abertas são indicadas com a cor vermelha, enquanto as das camadas fechadas são indicadas com a cor azul. As camadas se referem ao número quântico "n", o primeiro dos quatro.
Dessa forma, a configuração do Valência do H (↑ do vermelho) adiciona outro elétron com orientação oposta para se tornar a do HE (↓ ↑, ambos azuis porque agora o nível 1 está fechado). Este elétron adicionado é então o elétron diferencial.
Assim, pode -se observar como o elétron diferencial aumenta a camada de valência (setas vermelhas) dos elementos, diferenciando -os um do outro. Os elétrons preenchem os orbitais que respeitam a regra da pia e o princípio de exclusão de Pauling (perfeitamente observado de B ao NE).
E os números quânticos? Eles definem cada seta - ou seja, cada elétron - e seus valores podem ser corroborados com a configuração eletrônica para saber se os do elétron diferencial são ou não.
Pode atendê -lo: quais são os efeitos negativos que temos com a solubilidade da água?Exemplos de elétrons diferenciais em vários elementos
Cloro
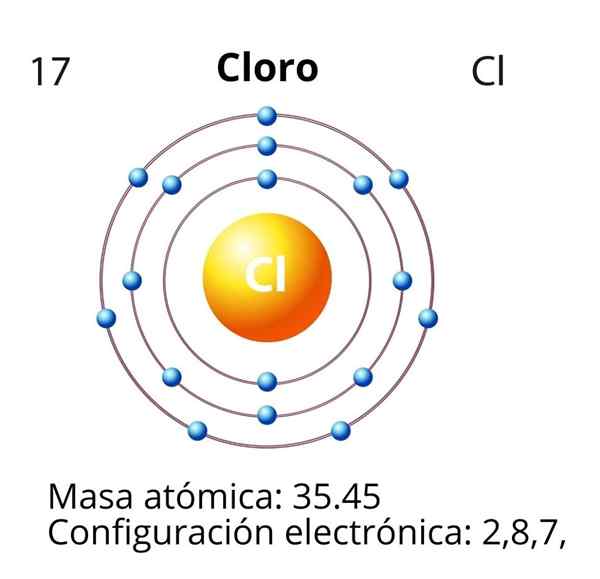
No caso do cloro (CL), seu número atômico z é igual a 17. A configuração eletrônica é então 1s22s2sp63s23p5. Os orbitais marcados em vermelho correspondem aos da camada de Valência, que apresenta o nível 3 aberto.
O elétron diferencial é o último elétron que é colocado na configuração eletrônica, e o átomo de cloro é o do orbital 3p, cuja disposição é a seguinte:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Respeitando a regra da pia, os orbitais 3p são preenchidos pela primeira vez com energia igual (uma seta para cima em cada orbital). Segundo, os outros elétrons acasalam com os elétrons solitários para a esquerda para a direita. O elétron diferencial é representado em um quadro verde.
Assim, o elétron diferencial para cloro tem os seguintes números quânticos: (3, 1, 0, -1/2). Isto é, "n" é 3; "L" é 1, orbital "p"; "M" é 0, porque é o orbital "p" do meio; E "S" é -1/2, já que a flecha aponta para baixo.
Magnésio
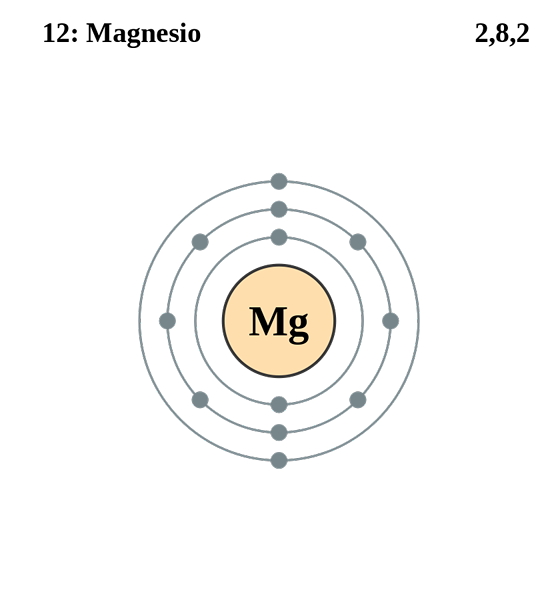 Configuração eletrônica de magnésio. Fonte: Electron_shell_012_magnesium.SVG: Pumbaa (trabalho original de Greg Robson) Trabalho derivado: Kizar, CC BY-SA 3.0, via Wikimedia Commons
Configuração eletrônica de magnésio. Fonte: Electron_shell_012_magnesium.SVG: Pumbaa (trabalho original de Greg Robson) Trabalho derivado: Kizar, CC BY-SA 3.0, via Wikimedia Commons A configuração eletrônica para o átomo de magnésio é 1s22s2sp63s2, Representando o orbital e seu elétron de Valência da mesma maneira:
↑ ↓
3s
0
Desta vez, o elétron diferencial tem números quânticos 3, 0, 0, -1/2. A única diferença neste caso em relação ao cloro é que o número quântico "L" é 0 porque o elétron ocupa um "s" orbital (os 3s).
Zirconio
A configuração eletrônica para o átomo de zircônio (metal de transição) é 1s22s2sp63s23p64s23d104p65s24d2. Da mesma maneira que os casos anteriores, a representação dos orbitais e elétrons de Valencia é a seguinte:
Pode atendê -lo: ciclopentano (C5H10): estrutura, propriedades e usos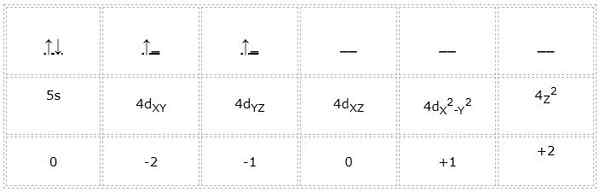
Assim, os números quânticos para o elétron diferencial marcado em verde são: 4, 2, -1, +1/2. Aqui, como o elétron ocupa o segundo orbital "d", ele tem um número quântico "m" igual a -1. Além disso, como a seta aponta, seu número de rotação "s" é igual a +1/2.
Elemento desconhecido
Os números quânticos do elétron diferencial para um elemento desconhecido são 3, 2, +2, -1/2. Qual é o número atômico z do elemento? Saber z pode decifrar qual é o elemento.
Desta vez, como "n" é o mesmo 3, significa que o elemento está no terceiro período da tabela periódica, com os orbitais "d" como camada de Valencia ("l" igual a 2). Portanto, os orbitais são representados como no exemplo anterior:
Inal
Os números quânticos "m" iguais a +2 e "s" iguais a -1/2, são essenciais para localizar corretamente o elétron diferencial no último orbital 3D.
Assim, o elemento procurado tem orbitais 3D10 completo, como suas camadas eletrônicas internas. Em conclusão, o elemento é o metal zinco (Zn).
No entanto, o número quântico do elétron diferencial não pode discernir entre zinco e cobre, porque esse último elemento também apresenta os orbitais 3D completos. Porque? Porque o cobre é um metal que falha com as regras cheias de elétrons por razões quânticas.
Referências
- Jim Branson. (2013). Regras da pia. Recuperado da Quantummechanics.Ucsd.Edu
- Palestra 27: Regras da Sink. Recuperado do pH.Qmul.AC.Reino Unido
- Universidade de Purdue. Números quânticos e configurações de elétrons. Retirado de Murmed.Chem.Purdue.Edu
- Enciclopédia de Salvat. (1968). Salvat Physics, S.PARA. de Pamplona Editions, Volume 12, Espanha, p. 314-322.
- Walter J. Moore. (1963). Química Física. Em Partículas e ondas. Quarta edição, Longmans.

