Fosfato de cálcio (CA3 (PO4) 2)

- 3085
- 872
- Shawn Leffler
Ele fosfato de cálcio É um sal inorgânico e terciário cuja fórmula química é CA3(Po4)2. A fórmula estabelece que a composição deste sal é 3: 2 para cálcio e fosfato, respectivamente. Isso pode ser visto diretamente na imagem inferior, onde o catiário é mostrado2+ E o ânion PO43-. Para cada três ca2+ Existem dois Po43- interagindo com eles.
Por outro lado, o fosfato de cálcio refere -se a uma série de sais que variam dependendo da relação Ca/P, bem como o grau de hidratação e pH. De fato, existem muitos tipos de fosfatos de cálcio que existem e podem ser sintetizados. No entanto, após a letra, a nomenclatura, o fosfato de cálcio alude apenas ao tricical, o acima mencionado.
 Proporção e íons em fosfato tricical. Fonte: Richard-59 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], da Wikimedia Commons
Proporção e íons em fosfato tricical. Fonte: Richard-59 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], da Wikimedia Commons Todos os fosfatos de cálcio, incluindo CA3(Po4)2, São sólidos brancos com leves tons cinzentos. Eles podem ser granulares, finos, cristalinos e ter tamanhos de partículas que estão ao redor dos micrômetros; E até as nanopartículas desses fosfatos foram preparadas, com as quais os materiais biocompatíveis para os ossos são projetados.
Essa biocompatibilidade é porque esses sais são encontrados nos dentes e em contas curtas em tecidos ósseos de mamíferos. Por exemplo, a hidroxiapatita é um fosfato de cálcio cristalino, que por sua vez interage com uma fase amorfa do mesmo sal.
Isso significa que existem fosfatos de calcios amorfos e cristalinos. Por esse motivo, não é surpreendente a diversidade e várias opções ao sintetizar materiais com base em fosfatos de cálcio; Materiais em cujas propriedades todos os dias são pesquisadores mais interessados em todo o mundo para se concentrar na restauração óssea.
Estrutura de fosfato de cálcio
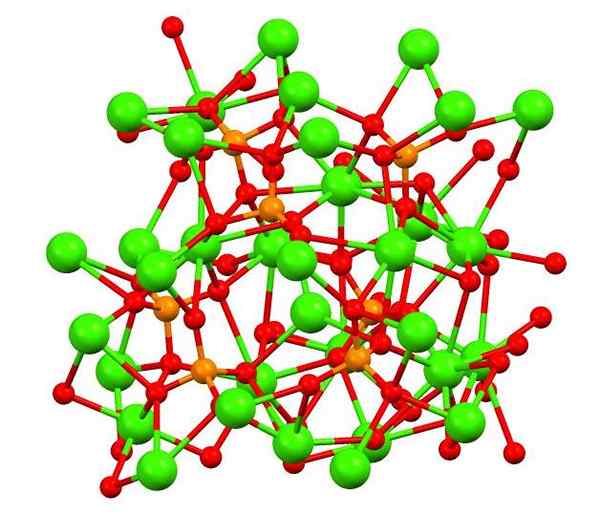 Fosfato de cálcio no mineral de Whitlockita. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons
Fosfato de cálcio no mineral de Whitlockita. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons A imagem superior mostra a estrutura do fosfato bálico tribásico no estranho mineral de Whitlockita, que pode conter magnésio e ferro como impurezas.
Embora à primeira vista possa parecer complexo, é necessário esclarecer que o modelo assume interações covalentes entre os átomos de oxigênio de fosfatos e centros de metal de cálcio.
Pode servir você: hidreto de berílio (Beh2)Como representação, é válida, no entanto, as interações são eletrostáticas; isto é, cátions2+ sentir atração por PO43- (AC2+- O-PO33-). Com isso em mente, entende -se por que, na imagem, cálcio (esferas verdes) são cercadas por átomos de oxigênio carregados negativamente (esferas vermelhas).
Quando há tantos íons, um arranjo ou padrão simétrico não deixa visível. O CA3(Po4)2 adota em baixas temperaturas (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(Po4)2 (β-TCP, por sua sigla em inglês).
Em altas temperaturas, por outro lado, torna-se o polimorfo α-CA3(Po4)2 (α-TCP), cuja célula unitária corresponde a um sistema cristalino monoclínico. A temperaturas ainda mais altas, o polimorfo α'-CA também pode ser formado3(Po4)2, que é a estrutura cristalina hexagonal.
Fosfato de cálcio amorfo
Estruturas cristalinas para fosfato de cálcio foram mencionadas, o que é esperado de um sal. No entanto, isso é capaz de exibir.
Quando isso ocorre, diz -se que o fosfato de cálcio tem uma estrutura amorfa (ACP, Fosfato de cálcio amorfo). Vários autores apontam para esse tipo de estrutura como responsável pelas propriedades biológicas da CA3(Po4)2 Nos tecidos ósseos, o reparo e a biomimetização sendo possível.
O resto da família
Os fosfatos de cálcio são de fato uma família de compostos inorgânicos, que por sua vez podem interagir com uma matriz orgânica.
Os outros fosfatos são obtidos "simplesmente" mudando os ânions que acompanham o cálcio (PO43-, HPO42-, H2Po4-, Oh-), como o tipo de impurezas no sólido. Assim, até onze cálcio ou mais fosfatos, cada um com sua própria estrutura e propriedades, pode ser originada naturalmente ou artificialmente.
Alguns fosfatos e suas respectivas estruturas e fórmulas químicas serão mencionadas abaixo:
-Fosfato de cálcio di -hidrado de hidrogênio, cahpo4∙ 2h2O: monoclínico.
Pode atendê -lo: oxalato de amônio-Fosfato de cálcio monohidrado de di -hidrogênio, CA (H2Po4)2∙ h2O: triclínico.
-Fosfato de doase anidro, CA (H2Po4)2: Triclinic.
-Fosfato octacalcico de hidrogênio (OCP), CA8H2(Po4)6: Triclinic. É um precursor na síntese de hidroxiapatita.
-Hidroxiapatita, CA5(Po4)3OH: hexagonal.
Propriedades físicas e químicas
Nomes
-Fosfato de cálcio
-Fosfato tricálcico
-Difosfato triccal
Peso molecular
310,74 g/mol.
Descrição física
É um sólido branco.
Sabor
Insípido.
Ponto de fusão
1670 ºK (1391 ºC).
Solubilidade
-Praticamente insolúvel em água.
-Insolúvel em etanol.
-Solúvel em ácido clorídrico e ácido nítrico diluído.
Densidade
3,14 g/cm3.
Índice de refração
1.629
Entalpia de treinamento padrão
4126 kcal/mol.
Temperatura de armazenamento
2-8 ºC.
ph
6-8 em uma suspensão aquosa de 50 g/L de fosfato de cálcio.
Treinamento
Fosfato de amônio de cálcio e hidrogênio e hidrogênio
Existem inúmeros métodos para produzir ou formar fosfato de cálcio. Um deles consiste em uma mistura de dois sais, CA (não3)2∙ 4H2Ou, e (NH4)2HPO4, anteriormente dissolvido em álcool e água absoluta, respectivamente. Um sal contribui com cálcio e o outro fosfato.
A partir desta mistura, o ACP precipita, que passa por aquecimento em um forno a 800 ° C e por 2 horas. Como resultado deste procedimento, β-CA é obtido3(Po4)2. Controlar cuidadosamente temperaturas, agitação e tempos de contato, a formação de nanocristais pode ocorrer.
Para formar o polimorfo α-CA3(Po4)2 É necessário aquecer o fosfato acima de 1000 ° C. Esse aquecimento é realizado na presença de outros íons metálicos, que estabilizam esse polimorfo o suficiente para que possa ser usado à temperatura ambiente; isto é, permanece em um estado -alvo estável.
Hidróxido de cálcio e ácido fosfórico
O fosfato de cálcio também pode ser formado pela mistura de soluções de hidróxido de cálcio e ácido fosfórico, ocorrendo neutralização ácida-base. Após meio dia de maturação nos espíritos da mãe e sua devida filtração, lavagem, secagem e peneirada, uma poeira granular de fosfato amorfo, ACP é obtido.
Este produto de reações ACP de altas temperaturas, transformando -se de acordo com as seguintes equações químicas:
2CA9(HPO4) (Po4)5(OH) => 2CA9(P2QUALQUER7)0,5(Po4)5(Oh) + h2O (A T = 446,60 ° C)
2CA9(P2QUALQUER7)0,5(Po4)5(OH) => 3CA3(Po4)2 + 0,5h2O (A T = 748,56 ° C)
Pode atendê -lo: selênio: história, propriedades, estrutura, obtenção, usosDessa maneira, o β-CA é obtido3(Po4)2, Seu polimorfo mais comum e estável.
Formulários
No tecido ósseo
O CA3(Po4)2 É o principal constituinte inorgânico de cinzas ósseas. É um componente dos transplantes de substituição óssea, sendo explicado por sua similaridade química com os minerais presentes no osso.
Os biomateriais de fosfato de cálcio são usados para corrigir defeitos ósseos e na cobertura das próteses de metal. O fosfato de cálcio é depositado neles, isolando -os do meio ambiente e desacelerando o processo de corrosão do titânio.
Cimentos biocerâmicos
O cimento fosfato de cálcio (CPC) é outro biocerâmico usado no reparo do tecido ósseo. É elaborado misturando a poeira de diferentes tipos de fosfatos de cálcio com água, formando uma pasta. Massas podem ser injetadas ou ajustadas ao defeito ósseo ou cavidade.
Os cimentos são moldados, gradualmente reabsorvidos e substituídos pelo osso recém -formado.
Médicos
-O CA3(Po4)2 É um sal básico, por isso é usado como um antiácido para neutralizar o excesso de acidez do estômago e aumentar o pH. Em massas dentárias fornecem uma fonte de cálcio e fosfato para facilitar o processo de remineralização de dentes e hemostasia óssea.
-Também é usado como um suplemento nutricional, embora a maneira mais econômica de fornecer cálcio seja usando seu carbonato e citrato.
-O fosfato de cálcio pode ser usado no tratamento da Tethany, hipocalcemia latente e terapia de manutenção. Além disso, é útil na suplementação de cálcio durante a gravidez e a amamentação.
-É usado no tratamento da contaminação com o rádio radioativo isotopos (RA-226) e estrôncio (SR-90). O fosfato de cálcio bloqueia a absorção de isotopos radioativos no trato digestivo, limitando assim os danos causados por eles.
Outros
-O fosfato de cálcio é usado como alimentação para pássaros. Além disso, é usado em pastas dentárias no controle do tártaro.
-É usado como um agente anti -gomerante, por exemplo, para impedir que o sal de mesa seja compacto.
-Funciona como um agente clareador da farinha. Enquanto isso, na manteiga de Cochino impede uma coloração indesejada e melhora a condição de fritar.
Referências
- Fosfato de cálcio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Fosfato de cálcio. Ciência direta. Recuperado de: ScientEdirect.com
- « História e significado da bandeira indonésia
- Tlachichinole o que é, características, benefícios, aplicação »

