Fluoreto de potássio (KF)
- 4902
- 13
- Lonnie MacGyver
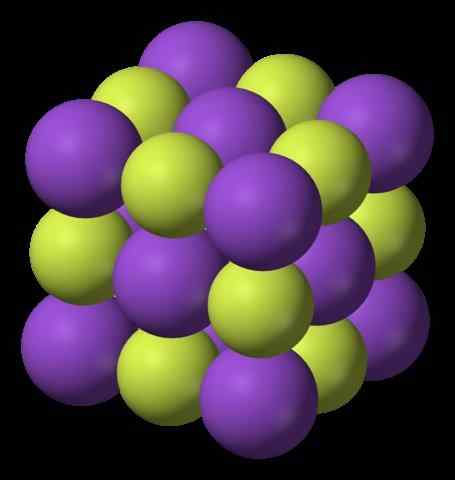
 Estrutura de fluoreto de potássio. Fonte: Benjah-BMM27, Wikimedia Commons
Estrutura de fluoreto de potássio. Fonte: Benjah-BMM27, Wikimedia Commons O que é fluoreto de potássio?Ele Fluoreto de Potássio É uma halogenidade inorgânica que consiste em um sal formado entre metal e halogênio. Sua fórmula química é KF, o que significa que para cada cátion k+ Há um f- de contraparte. As interações são eletrostáticas e, como resultado.
Este sal é caracterizado por sua extrema solubilidade na água, por isso forma hidratos, absorve a umidade e é delicioso. Portanto, é muito fácil preparar soluções aquosas, que servem como fonte de ânions de fluoreto para todas as síntese, onde se deseja incorporá -lo a alguma estrutura.
O KI é produzido reagindo carbonato de potássio com ácido fluorhorréico, produzindo bifluoreto de potássio (KHF2), que, devido à decomposição térmica, acaba causando fluoreto de potássio.
Estrutura de fluoreto de potássio
A imagem superior mostra a estrutura do flúor de potássio. As esferas roxas representam cátio+, Enquanto as esferas amareladas representam ânions f-.
Observe que o arranjo é cúbico e corresponde a uma estrutura de sal Gema, muito semelhante à do cloreto de sódio. Todas as esferas estão cercadas por seis vizinhos, que compõem um KF octaedro6 ou fk6, isto é, cada k+ É cercado por seis f-, E o mesmo vale para vice -versa.
Foi mencionado anteriormente que o KF é higroscópico e, portanto, absorve a umidade do ambiente. Assim, o arranjo mostrado corresponderia à forma anidra (sem água) e não aos seus hidratos, que absorvem tanta água que mesmo solubiliza e "derretia" (delicescência).
Pode atendê -lo: neon: história, propriedades, estrutura, riscos, usosHidrata
As estruturas cristalinas dos hidratos se tornam menos simples. Porque agora as moléculas de água intervêm diretamente nos arranjos e interagem com os íons k+ e f-. Um dos hidratos mais estáveis é o kf · 2h2O y kf · 4h2QUALQUER.
Em ambos os hidratos, os octaedros recém -mencionados são deformados por causa das moléculas de água. Isso se deve principalmente a pontes de hidrogênio entre f- e o h₂o (f--Hoh). Estudos cristalográficos determinaram que, apesar disso, os dois íons continuam a manter o mesmo número de vizinhos.
Como resultado, a estrutura cúbica original para o fluorur de potássio anidro.
Os Anhidros compartilham o Delicuest.
Propriedades do fluoreto de potássio
- Peso molecular: 58.097 g/mol.
- Aparência física (cor): Cristais cúbicos brancos ou pó de cristalina delicadeira.
- Sabor: sabor salino agudo.
- Ponto de ebulição: 2.741 ° F a 760 mmHg (1502 ° C). Em um estado líquido, torna -se um condutor de eletricidade, embora os ânions f possam- Não colabore no mesmo grau para dirigir que K+.
- Ponto de fusão: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). Isso é indicativo de seus fortes ligações iônicas.
- Solubilidade: Solúvel em HF, mas insolúvel em álcool. Isso mostra que as pontes de hidrogênio entre flúor e álcoois, f--HOR, eles não favorecem o processo de solvatação contra a dissolução de sua rede cristalina.
- Solubilidade em água: anidro 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); DiHydarded 349,3 g/100 ml (18 ° C). Ou seja, como o KF é hidratado, torna -se mais solúvel em água.
- Densidade: 2,48 g/cm3.
- Pressão de vapor: 100 kPa (750 mm Hg) em 1.499 ° C.
- Decomposição: Quando ele é aquecido para decomposição, ele emite uma fumaça tóxica de óxido de potássio e fluoreto de hidrogênio.
- Ação corrosiva: Uma solução aquosa corroge vidro e porcelana.
- Ponto de inflamação: Não é uma substância inflamável
- Índice de Refração Experimental (ηd): 1.363.
- Estabilidade: estável se estiver protegido da umidade, pois de outra forma o sólido é dissolvido. Incompatível com ácidos e bases fortes.
Usos de fluoreto de potássio
- Ajuste o pH: Soluções aquosas de fluoreto de potássio são usadas em aplicações e processos industriais. Por exemplo, as soluções KF permitem que o pH seja ajustado nos fabricantes que são realizados em instalações de processamento têxtil e lavanderia (elas aproximam um valor de 7).
- Fonte de fluorina: O fluoreto de potássio é, após o fluoreto de hidrogênio, a principal fonte de obtenção de flúor. Esse elemento é usado em usinas nucleares e na produção de compostos inorgânicos e orgânicos, alguns com usos como sua incorporação em dentifriques.
- Síntese de fluorocarbone: O fluoreto de potássio pode ser usado na síntese de ossanha fluor. Nesta reação, etileno glicol e dimetilsulfóxido são usados como solventes.
- Fluorinação: Como é uma fonte de flúor onde está dissolvida na água, de suas soluções que eles podem sintetizar fluoretos complexos, ou seja, eles são incorporados com f- para estruturas. Um exemplo está na seguinte equação química:
Mnbr2(AC) + 3KF (AC) => KMNF3(s) + 2kbr (CA)
- Em seguida, precipita o fluoreto misto da KMNF3. Assim, F poderia ser adicionado- fazer parte de um sal de metal complexo. Além do manganês, os fluoretos de outros metais podem se apressar: KCOF3, Kfef3, Knif3, KCF3 e kznf3.
- Da mesma forma, o fluoreto pode ser incorporado covalentemente em um anel aromático, sintetizando organizacional.
- Diversos: KF é usado como material intermediário ou bruto para a síntese de compostos que são usados principalmente em produtos agroquímicos ou pesticidas.
- Além disso, é usado como um agente fundador da solda.
Referências
- Fluoreto de Potássio. Recuperado do ChemicalBook.com.
- Fluoreto de Potássio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.

