Estrutura de fluoreto de magnésio, propriedades, síntese, usa
- 2217
- 289
- Orlando MacGyver
Ele Fluoreto de magnésio É um sal inorgânico incolor cuja fórmula química é mgf₂. É encontrado na natureza como o mineral de Sealíta. Tem um ponto de fusão muito alto e é muito pouco solúvel na água. É relativamente inerte, porque, por exemplo, sua reação ao ácido sulfúrico é lenta e incompleta e resiste à hidrólise com ácido fluorérico (HF) a 750ºC.
É um composto pouco afetado por radiação de alta energia. Além disso, possui um baixo índice de refração, alta resistência à corrosão, boa estabilidade térmica, dureza significativa e excelentes propriedades de transmissão de luz visíveis, UV (ultravioleta) e IR (infravermelho).

Essas propriedades têm excelente desempenho no campo óptico e, além disso, o tornam um material útil, como suporte de catalisador, elemento de revestimento, lentes anti -reflexos e janelas para transmissão infravermelha, entre outros aplicativos.
[TOC]
Estrutura
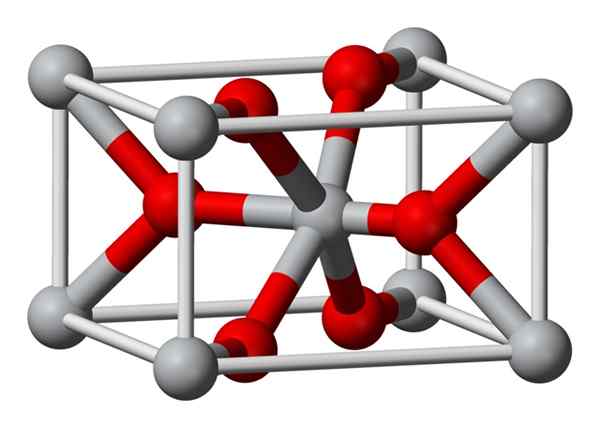
A estrutura cristalina do fluoreto de magnésio preparada quimicamente é o mesmo tipo que a do mineral natural de Sellaíta. Cristaliza na classe dipiramidal do sistema tetragonal.
Os íons magnésio (Mg2+) estão localizados em um espaço centrado no espaço tetragonal, enquanto os íons fluoreto (F-) são encontrados no mesmo plano de seus vizinhos Mg2+ e associados a estes, agrupados em pares com cada um. A distância entre os íons Mg2+ e F- é 2,07 Å (Angstroms) (2,07 × 10-10m).
Sua coordenação cristalina é 6: 3. Isso significa que cada íon mg2+ é cercado por 6 íons f- e cada íon f-, por sua vez, é cercado por 3 mg2+ 5 íons.
A estrutura é muito semelhante à do mineral de Rutilo, que é a forma natural de dióxido de titânio (TiO2), com o qual possui várias propriedades cristãos em comum.
Durante sua obtenção, o fluoreto de magnésio não precipita na forma de sólido amorfo, porque os íons Mg2+ e F não tendem a formar complexos poliméricos em solução.
Propriedades
É interessante enfatizar que o fluoreto de magnésio é um material birrefringent. Esta é uma propriedade óptica que permite que você desdobre um raio de luz incidente em dois raios separados que se espalham em diferentes ondas e comprimentos de onda.
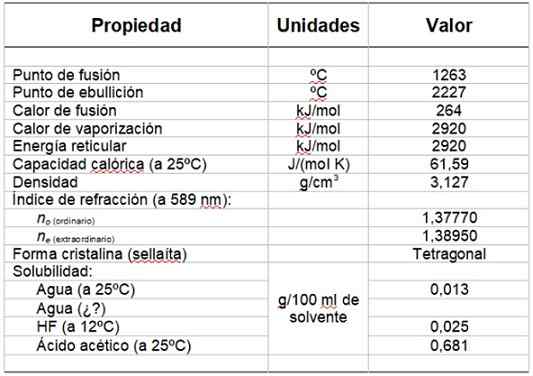
Pode atendê -lo: grupo hidroxilaA Tabela 1 mostra algumas de suas propriedades.
tabela 1. Propriedades físicas e químicas do fluoreto de magnésio.
Síntese e preparação
Pode ser preparado de várias maneiras, entre as seguintes seguintes
1 porque a reação entre óxido de magnésio (MGO) ou carbonato de magnésio (MGCO3) com ácido fluoreto (HF) 2:
MGO + 2 HF MGF2 + H2O
MgCo3 + 2 hf mgf2 + CO2 + h2O
REAÇÃO DE 2-PARA entre carbonato de magnésio e bifluoruro de amônio (NH4HF2), ambos em estado sólido, a uma temperatura entre 150 e 400ºC2:
150-400ºC
MgCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-Calento Uma solução aquosa de carbonato de magnésio e fluoreto de amônio (NH4F) na presença de hidróxido de amônio (NH4OH) a 60ºC 2:
60ºC, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
O precipitado de fluoreto de amônio e magnésio (NH4mgf3) é então aquecido a 620ºC por 4 horas para obter fluoreto de magnésio:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-como o subproduto de obter berílio (BE) e urânio (u). O fluoreto do elemento desejado com magnésio metálico é aquecido em um caldeirão MGF2 2 -Coberto: caldeirão:
Bef2 + mg ser + mgf2
Cloreto de magnésio reagir 5 (mgcl2) com fluoreto de amônio (NH4F) em solução aquosa à temperatura ambiente 3:
25ºC, H2O
MGCL2 + 2 NH4F MGF2 + 2NH4CL
Como os métodos de preparação para MGF2 são caros, há tentativas de obtê -lo de maneira mais economicamente, entre os quais o método de produzi -lo a partir da água do mar.
Pode atendê -lo: hidreto de cálcio (CAH2): propriedades, reatividade e usosIsso é caracterizado por adicionar íons de fluoreto suficientes (F-) à água do mar, que possui uma concentração abundante de íons de magnésio (MG2+), favorecendo assim a precipitação de MGF2.
Os cristais ópticos de fluoreto de magnésio são obtidos por pressão quente do MGF2 de alta qualidade, obtidos, por exemplo, pelo método NH4HF2.
Existem muitas técnicas para preparar materiais de fluoreto de magnésio, como crescimento de vidro único, sinterização (compactação para moldar ou formar) sem pressão, quente e sinterizante pressionado com microondas.
Formulários
Óptica
Os cristais MGF2 são adequados para aplicações ópticas porque são transparentes da região UV para a média de 2,10 da região IR de 2,10.
Como um filme inerte é usado para alterar as propriedades de transmissão de luz de materiais ópticos e eletrônicos. Uma das principais aplicações está na óptica VUV para tecnologia de exploração espacial.
Devido à sua propriedade de birrefringência, esse material é útil na óptica de polarização, nas janelas e prismas de laser Ecimer (tipo de laser ultravioleta usado em cirurgia ocular).
Deve-se notar que o fluoreto de magnésio usado na fabricação de materiais ópticos de filme fino deve estar livre de impurezas ou compostos que são fonte de óxido, como água (H2O), íons hidróxidos (OH-), íons carbonatos (CO3 = ), Íons sulfatos (SO4 =) e similares 12.
Catálise ou aceleração de reações
O MGF2 foi usado com sucesso como suporte de catalisador para a reação da eliminação de cloro e a adição de hidrogênio no CFC (clorofluorocarbonetos), refrigerantes bem conhecidos e propulsores de aerossol e responsáveis pelos danos à atmosfera ozona.
Os compostos resultantes, HFC (hidrofluorocarbones) e HCFC (hidroclorofluorocarbones), não apresentam esse efeito prejudicial à atmosfera 5.
Também tem sido útil como suporte para catalisadores para hidrodesulfração (eliminação de enxofre) de compostos orgânicos.
Pode servir a você: Equilíbrio Químico: Explicação, Fatores, Tipos, ExemplosOutros usos
Os materiais gerados por grafite, fluorina e interlamear MGF2.
O Eutctic formado por NAF e MGF2 apresenta propriedades de armazenamento de energia em calor latente, por isso foi considerado para uso em sistemas de energia solar.
Na área da bioquímica, o fluoreto de magnésio, juntamente com outros fluoretos de metal, é usado para inibir as reações de transferência de fosforil em enzimas.
Recentemente, as nanopartículas MGF2 foram testadas com sucesso como vetores de colocação de medicamentos em células doentes para tratamento de câncer.
Referências
- Buckley, h.E. e Vernon, W.S. (1925) XCIV. A estrutura cristalina do fluoreto de magnésio. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química, volume 11, quinta edição, John Wiley & Sons. ISBN 0-471-52680-0 (V.onze).
- Peng, Minhong; Cao, Weiping; e música, Jinhong. (2015). Preparação de cerâmica translúcida MGF2 por sinterização de prensagem a quente. Journal of Wuhan University of Technology-Mater: SCI. Ed. Vol. 30 não. 4.
- Ноооно Go, и.С. (2011). Fluoreto magnésio. Fonte: Trabalho próprio.
- Wojciechowska, Maria; Zielinski, Michal; e Piettowski, Mariusz. (2003). MGF2 como um suporte de catalisador não-convencional. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluoreto magnésio (MGF2). Consultado em 12/07/2019 em: Korth.de
- Sevonkaev, Igor e Matijevic, Egon. (2009). Formação de partículas de fluoreto de magnésio de diferentes morfologias. Langmuu 2009, 25 (18), 10534-10539.
- Ноооно Go, и.С. (2013). Fluoreto magnésio. Fonte: Trabalho próprio.
- Tao Qin, Peng Zhang e Weiwei Qin. (2017). Um novo método para sintetizar esferas de fluoreto de magnésio de baixo custo da água do mar. Ceramics International 43 (2017) 14481-14483.
- Enciclopédia de química industrial de Ullmann (1996) Quinta edição. Volume A11. Vch verlagsgellschaft mbh. Nova Iorque. ISBN 0-89573-161-4.
- NASA (2013). Engenheiros inspecionando o espelho primário do telescópio espacial Hubble 8109563. Fonte: Mix.Msfc.Panela.Gov
- « Origem, características e exemplos da escrita pictográfica
- Características e exemplos de transações comerciais »

