Etano
- 3768
- 1101
- Melvin Mueller
 Estrutura de Estano
Estrutura de Estano O que é etano?
Ele Etano É um hidrocarboneto simples de fórmula C2H6 Com uma natureza de gás incolor e banheiro que tem uso altamente valioso e diversificado na síntese de etileno. Além disso, é um dos gases terrestres que também foi detectado em outros planetas e corpos estrelados ao redor do sistema solar. Foi descoberto pelo cientista Michael Faraday em 1834.
Entre o grande número de compostos orgânicos formados por átomos de carbono e hidrogênio (conhecidos como hidrocarbonetos), existem aqueles que estão em um estado gasoso em temperaturas e pressões ambientais, que são muito usadas em inúmeras indústrias.
Eles geralmente vêm da mistura gasosa chamada "gás natural", um produto de alto valor para a humanidade e compõem os tipos de metano, etano, propano e butano, entre outros; qualificação de acordo com a quantidade de átomos de carbono em sua cadeia.
Estrutura química de etano
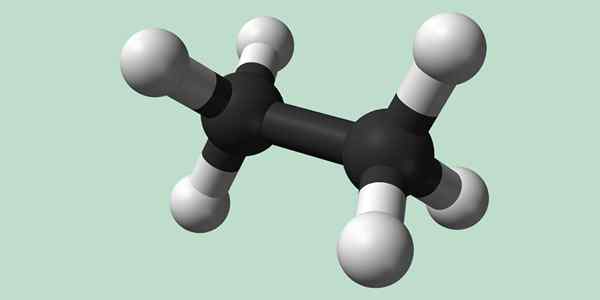
Estano é uma molécula de fórmula C2H6, normalmente visto como uma união de dois grupos metil (-ch3) Para formar o hidrocarboneto de uma ligação simples de carbono-carbono. É também o composto orgânico mais simples após o metano, representando -se:
H3C-CH3
Os átomos de carbono nesta molécula têm hibridação do tipo SP3, Portanto, as ligações moleculares têm rotação livre.
Há também um fenômeno intrínseco de etano, que se baseia na rotação de sua estrutura molecular e na energia mínima necessária para produzir uma rotação de link de 360 graus, que os cientistas chamaram de "etano Barrera".
Por esse motivo, Ethan.
 Estrutura química de etano. Fonte: Wikimedia Commons
Estrutura química de etano. Fonte: Wikimedia Commons Síntese de etano
O estano pode ser facilmente sintetizado a partir da eletrólise de Kolbe, uma reação orgânica na qual ocorrem duas etapas: uma descarboxilação eletroquímica (remoção do grupo carboxila e libertação de dióxido de carbono) de dois ácidos carboxílicos e a combinação dos produtos intermediários para formar uma ligação covalente.
Da mesma forma, a eletrólise do ácido acético resulta na formação de etano e dióxido de carbono, e essa reação é usada para sintetizar o primeiro.
A oxidação do anidrido acético pela ação dos peróxidos, um conceito semelhante à eletrólise de Kolbe, também resulta na formação de etano.
Pode atendê -lo: contribuições da química para a humanidadeDa mesma forma, pode ser separado com eficiência do gás natural e do metano por um processo de liquefação, usando sistemas criogênicos para capturar esse gás e separá -lo das misturas com outros gases.
O processo de expansão turbo é o favorito para esse papel: a mistura de gás é feita por uma turbina, gerando uma expansão dela, até que sua temperatura caia abaixo de -100 ° C.
Já neste momento, os componentes da mistura podem ser diferenciados; portanto, o etano líquido do metano gasoso e as outras espécies envolvidas com o uso de uma destilação será separada.
Estano Propriedades
Estano é apresentado na natureza como banheiro e gás incolor para pressões e temperaturas padrão (1 atm e 25 ° C). Tem um ponto de ebulição de -88,5 ° C e um ponto de fusão de -182,8 ° C. Além disso, não é afetado pela exposição a ácidos ou bases fortes.
Solubilidade do etano
As moléculas de etano são configurações simétricas e têm forças de atração fracas que as mantêm juntas, chamadas forças de dispersão.
Quando o etano tenta se dissolver na água, as forças de atração formadas entre gás e líquido são muito fracas, para que o etano dificilmente se junte às moléculas de água.
Por esse motivo, a solubilidade do etano é consideravelmente baixa, aumentando um pouco quando a pressão do sistema aumenta.
Cristalização do etano
Estano pode ser solidificado, tornando os cristais de etano instáveis com estrutura cristalina cúbica.
Com uma diminuição de temperatura além de -183,2 ° C, essa estrutura se torna monoclínica, aumentando a estabilidade de sua molécula.
Combustão de etano
Esse hidrocarboneto, mesmo quando não é amplamente usado como combustível, pode ser usado em processos de combustão para gerar dióxido de carbono, água e calor, que são representados da seguinte forma:
2 c2H6 + 7º2 → 4CO2 + 6h2O + 3120 KJ
Existe também a possibilidade de queimar essa molécula sem excesso de oxigênio, conhecida como "combustão incompleta" e que resulta na formação de carbono amorfo e monóxido de carbono em uma reação indesejada, de acordo com a quantidade de oxigênio aplicado:
Pode atendê -lo: Esteróis: estrutura, funções e exemplos2 c2H6 + 3º2 → 4c + 6h2Ou + calor
2 c2H6 + 4º2 → 2c + 2co + 6h2Ou + calor
2 c2H6 + 5 ª2 → 4CO + 6H2Ou + calor
Nesta área, a combustão ocorre por uma série de reações de radicais livres, que são numerados nas centenas de reações diferentes. Por exemplo, em reações de combustão incompletas, compostos como formaldeído, acetaldeído, metano, metanol e etanol podem ser formados.
Isso dependerá das condições em que a reação e as reações dos radicais livres envolvidos ocorrem. O etileno também pode se formar em altas temperaturas (600-900 ° C), que é um produto altamente desejado pela indústria.
Estano na atmosfera e em corpos celestes
Estano está presente na atmosfera do planeta Terra em traços, e suspeita -se que o ser humano tenha dobrado essa concentração desde que ele começou a praticar atividades industriais.
Os cientistas pensam que grande parte da presença atual de ETA na atmosfera se deve à combustão de combustíveis fósseis, embora a emissão mundial de etano tenha diminuído quase a metade do caminho, pois as tecnologias de produção de gás Lutita foram aprimoradas (uma fonte de gás natural).
Esta espécie também ocorre naturalmente pelo efeito dos raios solares no metano atmosférico, que recombina e forma uma molécula de etano.
Há um etano no estado líquido na superfície de Titan, uma das luas de Saturno. Isso é apresentado em maior quantidade no rio Vid Flumina, que flui por mais de 400 quilômetros para um de seus mares. Este composto também foi evidenciado nos cometas e na superfície de Plutão.
Usos de etano
Produção de etileno
O uso de etano é baseado principalmente na produção de etileno, o produto orgânico de maior uso na produção mundial, através de um processo conhecido como estágio de vapor.
Este processo consiste em passar um Ethan diluído.
A reação ocorre a uma temperatura extremamente alta (entre 850 e 900 ° C), mas o tempo de permanência (o tempo em que o etano passa dentro do forno) deve ser breve para que a reação seja eficaz. Em temperaturas mais altas, mais etileno são gerados.
Pode atendê -lo: neon: história, propriedades, estrutura, riscos, usosFormação química básica
Etano também foi estudado como o principal componente na formação de produtos químicos básicos. A cloração oxidativa é um dos processos criados para obter cloreto de vinil (um componente de PVC), substituindo outros menos econômicos e mais complicados.
Refrigerante
Finalmente, o etano é usado como refrigerante em sistemas criogênicos comuns, mostrando também capacidades de congelar pequenas amostras no laboratório para análise.
É um substituto muito bom para a água, o que leva mais para esfriar as amostras delicadas e também pode gerar a formação de cristais de gelo prejudiciais.
Riscos de etano
-Estano tem a capacidade de ficar inflamado, principalmente quando se junta ao ar. Uma porcentagem de 3,0 a 12,5% de volume de etano no ar, uma mistura explosiva pode ser formada.
-Ele pode limitar o oxigênio no ar em que é encontrado e, por esse motivo, apresenta um fator de risco para asfixia para pessoas e animais presentes e expostos.
-O etano na forma líquida congelada pode queimar seriamente a pele se entrar em contato direto com ele e também agir como um meio criogênico para qualquer objeto que tocar, congelando -o em momentos.
-Os vapores de etano líquido são mais pesados que o ar e se concentram no solo, isso pode apresentar um risco de ignição que pode gerar uma reação de combustão em cadeia.
-A ingestão de etano pode causar náusea, vômito e hemorragias internas. A inalação, além da asfixia, causa dores de cabeça, confusão e mudança de humor. A morte devido à parada cardíaca é possível em altas exposições.
-Representa um gás de efeito estufa que, juntamente com metano e dióxido de carbono, contribui para o aquecimento global e as mudanças climáticas geradas pela poluição humana. Felizmente, é menos abundante e duradouro que o metano, e absorve menos radiação do que isso.
Referências
- Britannica, e. (s.F.). Etano. Obtido da Britannica.com
- NES, g. V. (s.F.). Estruturas de cristal único e distribuições de densidade de elétrons de etano, ethileno e acetileno. Tapete recuperado.Nl
- Sites, g. (s.F.). Etano: fontes e pias. Obtido de sites.Google.com
- Softschools (s.F.). Fórmula de etano. Recuperado de Softschools.com
- Wikipedia (s.F.). Etano. Obtido de in.Wikipedia.org

