Estrutura terciária dos principais recursos das características

- 1930
- 376
- Orlando MacGyver
O Estrutura terciária de proteínas É a conformação tridimensional que as cadeias polipeptídicas adquirem ao dobrar em si mesmas. Essa conformação aparece pelas interações entre as cadeias laterais do desperdício de aminoácidos do polipeptídeo. As cadeias laterais podem interagir independentemente de sua posição na proteína.
Como depende das interações entre os grupos R, a estrutura terciária mostra aspectos não repetitivos da cadeia, pois esses grupos são diferentes para cada resíduo de aminoácidos. Estrutura secundária, por outro lado, depende de grupos carboxil e amino, que estão presentes em todos os aminoácidos.
 Estrutura terciária da proteína quinase fosfatase, com estruturas secundárias na folha alfa e beta. Tomado e editado de: A2-33. Modificado por Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Estrutura terciária da proteína quinase fosfatase, com estruturas secundárias na folha alfa e beta. Tomado e editado de: A2-33. Modificado por Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Alguns autores sugerem que as proteínas fibrosas têm uma estrutura terciária simples, mas, no entanto, outros autores apontam que essa estrutura é típica de proteínas globulares.
[TOC]
Proteínas fibrosas
Nas proteínas fibrosas, as cadeias polipeptídicas são dispostas na forma de filamentos longos ou lençóis longos; Eles geralmente são compostos por um tipo único de estrutura secundária. Essa estrutura secundária é, na maioria dos casos, mais importante que a estrutura terciária na determinação da forma de proteína.
Sua função biológica é estrutural e conferindo força e/ou elasticidade aos órgãos e estruturas onde são encontrados, mantendo -os juntos. Todas as proteínas fibrosas são insolúveis em água, devido à grande quantidade de aminoácidos hidrofóbicos que apresentam.
Entre essas proteínas fibrosas estão queratinas e colágeno. Os primeiros são encontrados em tecidos conjuntivos e em estruturas como cabelos, unhas (α-queatinas), escalas e penas (β-cheatinas). Enquanto isso, o colágeno é encontrado em ossos, tendões e pele, entre outros.
α-queatinas
Essas proteínas fazem parte das proteínas de filamentos intermediários de som, que desempenham um papel importante no citoesqueleto de organismos multicelulares. Além disso, eles são o principal constituinte de cabelos, pregos, lã, buzinas, cascos e uma das principais proteínas da pele animal.
Pode atendê -lo: mancha de kinyounA estrutura da molécula é uma hélice α. Dois fios de α-queatina podem ser dispostos em paralelo e inscrever um sobre o outro com seus grupos hidrofóbicos R interagindo entre eles. Dessa maneira.
A estrutura terciária da α queratina é simples e é dominada pela estrutura secundária da α-hélice. Por outro lado, a estrutura quaternária também está presente, pois duas moléculas participam da estrutura super -helicoidal, que interage através de ligações não -covalentes.
β-queatinas
A estrutura primária é semelhante à das α-queatinas, mas sua estrutura secundária é dominada por folhas β. Eles são o principal constituinte das escalas dos répteis e das penas dos pássaros.
Colágeno
Esta proteína pode representar mais de 30% da massa proteica total de alguns animais. É encontrado em cartilagos, ossos, tendões, córnea e pele, entre outros tecidos.
A estrutura secundária do colágeno é única, sendo representada por uma hélice de Levogira com 3,3 resíduos de aminoácidos para cada volta. Três cadeias de hélice levogyous (α).
As moléculas de tropocolágeno se reúnem para formar uma fibra de colágeno que tem grande resistência, maior que o aço e comparável com o cobre de alta resistência.
Outras proteínas fibrosas
Outros tipos de proteínas fibrosas são fibroína e elastina. O primeiro deles é formado por folhas β, constituídas principalmente por Glycina, Alanine e Serine.
As cadeias laterais desses aminoácidos são pequenas, para que possam ser embaladas de perto. O resultado é uma fibra que é muito resistente e muito sem serpretecida.
Pode servir a você: tampão fosfato (PBS): fundação, preparação e usosEnquanto isso, na elastina, a valina substitui a serina entre seus principais aminoácidos constituintes. Ao contrário do fibroína, a elastina é muito extensível, daí o seu nome. Na constituição da molécula, a lisina também atua, que pode participar de reticulação que permite que a elastina recupere sua forma quando a tensão cessa.
Proteínas globulares
As proteínas globulares, ao contrário de fibrosas, são solúveis e geralmente têm vários tipos de estruturas secundárias. No entanto, neles são mais importantes conformações tridimensionais que eles adquirem ao se dobrar sobre si mesmas (estrutura terciária).
Essas conformações tridimensionais em particular fornecem atividade biológica específica a cada proteína. A principal função dessas proteínas é regulatória, como nas enzimas.
Características da estrutura terciária de proteínas globulares
A estrutura terciária das proteínas globulares tem algumas características importantes:
- As proteínas globulares são compactas graças à embalagem quando as dobras da corrente do polipeptídeo.
- O desperdício de aminoácidos distante na estrutura primária das cadeias polipeptídicas é próximo, sendo capaz de interagir entre si por causa do dobramento.
- Proteínas globulares maiores (mais de 200 aminoácidos) podem ter vários segmentos compactos, independentes entre eles e com funções específicas, e cada um desses segmentos é chamado de domínio. Um domínio pode ter entre 50 e 350 resíduos de aminoácidos.
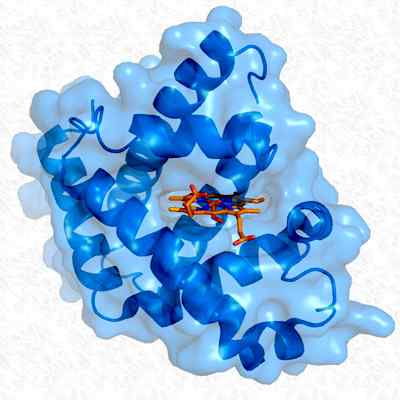 Estrutura terciária da mioglobina. Tomado e editado de: Thomas Splettstoer. Modificado por Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Estrutura terciária da mioglobina. Tomado e editado de: Thomas Splettstoer. Modificado por Alejandro Porto. [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Regras gerais da dobra de proteínas globais
Como já observado, as proteínas têm formas dobráveis específicas, que lhes dão também características particulares. Essa dobra não é aleatória e é favorecida pela estrutura primária e secundária e por algumas interações não -covalentes, e também existem algumas restrições físicas à dobra, portanto, algumas regras foram formuladas:
Pode atendê -lo: órgãos linfóides primários- Todas as proteínas globulares têm padrões de distribuição definidos, com grupos hidrofóbicos direcionados para a molécula e resíduos hidrofílicos na camada externa na camada externa. Para isso, pelo menos duas camadas de estrutura secundária são necessárias. O loop β-α-β e o vértice α-α podem contribuir com essas duas camadas.
- As folhas β são geralmente organizadas em uma forma laminada de Levogira.
- Em uma cadeia polipeptídica, diferentes voltas podem ocorrer para se mover de uma estrutura secundária para outra, como β ou γ, que podem ser capazes de investir a direção da cadeia em quatro resíduos de aminoácidos ou menos.
- Proteínas globulares têm folhas α, β, reviravoltas e segmentos de estrutura irregularmente.
Desnaturação de proteínas
Se uma proteína perde sua estrutura tridimensional nativa (natural), perde sua atividade biológica e a maioria de suas propriedades específicas. Este processo é conhecido como desnaturação.
A desnaturação pode ocorrer quando as condições ambientais naturais mudam, por exemplo, com temperatura ou pH variável. O processo é irreversível em muitas proteínas; No entanto, outros podem recuperar espontaneamente sua estrutura natural, restaurando as condições ambientais normais.
Referências
- C.K. Mathews, k.E. Van hold & k.G. Ahern (2002). Bioquímica. 3ª edição. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & V.C. Rodwell (1996). Bioquímica de Harper. Appleton & Lange.
- J.M. Berg, j.eu. Tymoczko & l. Stryer (2002). Bioquímica. 5ª edição. C. H. Freeman and Company.
- C.M. Becker, l.J. Kleinsmith & J. Hardin (2006) World of the Cell. 6ª edição. Pearson Education Inc.
- PARA.Lehninger (1978). Bioquímica. Omega Editions, S.PARA.
- T. McKee & J.R. McKee (2003). Bioquímica: a base molecular da vida. 3ª edição. A McGraw-Hiii Companies, Inc.
- « Propriedades, aplicações e exemplos de condensado fermiônico
- Sulfato de sódio dodecil (SDS) Estrutura, propriedades, usos »

