Sulfato de sódio dodecil (SDS) Estrutura, propriedades, usos
- 889
- 147
- Orlando MacGyver
Ele Dodecil de sulfato de sódio (SDS), é um sal orgânico aniônico, sintético e anfifílico. A parte apolar e hidrofóbica corresponde à cadeia de hidrocarbonetos; Enquanto a parte polar e hidrofílica é devida a sulfato, com carga negativa.
O SDS é um surfactante: suas moléculas são colocadas na superfície de soluções aquosas, produzindo uma diminuição na tensão superficial. Esse recurso permite seu uso em shampoo, cremes dentários, sabonetes e outros artigos de cuidados pessoais e limpeza doméstica.
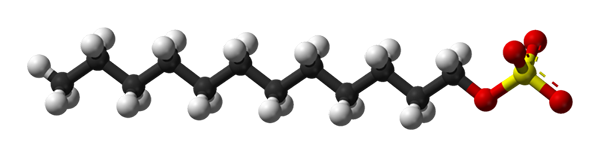
 Estrutura de dodecile de sulfato de sódio. Fonte: Benjah-BMM27 via Wikipedia.
Estrutura de dodecile de sulfato de sódio. Fonte: Benjah-BMM27 via Wikipedia. O dodecil do sulfato de sódio se liga à proteína e produz seu desdobramento, adquirindo uma forma alongada. Os grupos sulfatos são expostos à água, adquirindo proteínas de carga negativa, cujo número é proporcional ao peso molecular deles.
Por esse motivo, o SDS permite a determinação dos pesos moleculares das proteínas através da eletroforese em poliacrilamida.
Embora tenha sido suspeito um possível efeito carcinogênico do SDS, não foi demonstrado conclusivamente que é assim. Os SDs podem produzir, como outros detergentes, a pele e a irritação dos olhos.
[TOC]
Estrutura SDS
Na primeira imagem, a molécula SDS foi mostrada com um modelo de esferas e barras. Como pode ser visto, possui uma cauda de carbono hidrofóbica e apolar (esferas preto e branco); E ao mesmo tempo, uma cabeça polar, graças à presença do grupo -4- (esferas amarelas e vermelhas).
Embora não seja mostrado, deve haver uma esfera roxa representando a náutica+, bem ao lado do grupo -so4-, interagindo eletroestaticamente.
Dito isto, é entendido a olho nu por que esse composto é anfifílico; e também uma tensão aniônica, uma vez que a carga do SDS é negativa e pode atrair outros cátions, além do NA+.
A molécula dá a falsa impressão de ser rígido, uma estrutura linear imóvel. No entanto, é tudo o oposto. O SDS pode ser comparado a um "worm", cuja cauda de carbono apresenta múltiplas vibrações e rotações de seus links simples. Isso o torna capaz de adotar diferentes conformações ou dobras no meio; Na água, por exemplo.
Cristais
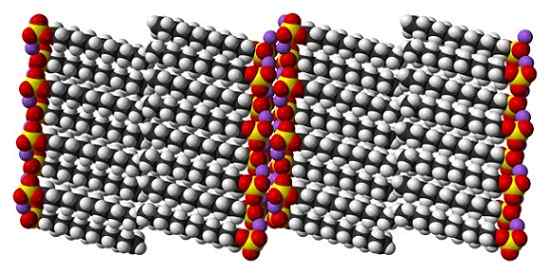 Estrutura cristalina de sulfato de dodecil sódica. Fonte: Benjah-BMM27 [Domínio Público]
Estrutura cristalina de sulfato de dodecil sódica. Fonte: Benjah-BMM27 [Domínio Público] Embora seja verdade que o dodecil do sulfato de sódio é uma molécula dinâmica, no estado sólido, não precisa se mover demais, se comportando como uma barra "simples". E assim, cada molécula ou barra está posicionada de tal maneira que as interações entre filas carbonatadas e, ao mesmo tempo, as de suas cargas iônicas aumentam.
Pode atendê -lo: clorito de sódio (naclo2): estrutura, propriedades, usos, riscosO resultado é a formação de um cristal monoclínico, onde as moléculas SDS são embaladas em várias colunas de barra (imagem superior). As forças intermoleculares que as unem são tal, que esses cristais exigem uma temperatura de 206ºC para derreter a fase líquida.
Micelas
Fora do conforto de seus cristais, a molécula SDS não pode mais permanecer imóvel; Comece a torcer sua cauda para aumentar ou reduzir as interações com o ambiente externo.
Se esse meio for água, ocorre um fenômeno chamado Micella Formation: Carbono e caudas hidrofóbicas se ligam ao rodeio, enquanto cabeças polares, grupos -assim4-, Eles permanecem na superfície interagindo com as moléculas H2QUALQUER.
Então, a micella adquire uma morfologia elipsóide oblato (como a Terra, mas mais esmagada). No cristal, eles são como blocos de barra e em um meio aquoso como micelas elipsóides. E se o meio fosse petrolífero? A MYCE seria investida: as cabeças polares então4- Eles iriam para o núcleo, enquanto suas caudas carbonatadas seriam expostas ao petróleo.
Propriedades
Nomes
- Dodecilsulfato de sódio (SDS).
- Laurilsulfato de sódio (SLS).
Fórmula molecular
C12H25QUALQUER4Sna.
Massa molar
288.378 g/mol.
Descrição física
Várias apresentações: poeira seca, líquido ou sólido úmido. Seus cristais têm uma coloração branca ou cremosa.
Cheiro
Pai cheiro de substâncias gordas, banheiro.
Ponto de fusão
206 ºC.
Solubilidade em água
1 · 105 mg/l. 1 g dissolvido em 10 ml de uma solução opalescente.
Densidade
1,01 g/cm3.
Estabilidade
É estável nas condições de armazenamento recomendadas.
Decomposição
Quando aquecido para decomposição emite uma fumaça branca de óxido de enxofre e óxido de sódio.
Tensão superficial
39,5 Dynas/cm a 25 ºC.
Concentração molar crítica
É 8,2 mm em água pura a 25 ° C.
Formulários
Cuidados pessoais e limpeza em casa
O dodecil de sulfato é um surfactante usado em vários produtos, como sabonetes de banheiro, banhos de espuma, cremes de barbear, etc. Também é usado para remover manchas da dificuldade para excluir, na limpeza dos pisos e banheiros, furiosos dos itens da cozinha etc.
Pode atendê -lo: petróleo ou éter benzina: fórmula, estrutura, usaMedicina veterinária e humana
É usado como um repelente de pulgas e carrapatos, presente em animais. Também é usado como hidratante em alguns antibióticos, para uso oral ou tópico.
O SDS é microbicida contra vírus com embalagem, como HIV, Tipos 1 e 2, e o Herpes Simple Herpes Virus (HSV-2). Ele também age sobre vírus sem embrulhar: papilomavírus, reovírus, rotavírus e poliovírus. No entanto, esse uso não é aprovado.
O uso de SDS foi sugerido como um chuveiro vaginal que fornece proteção contra vírus sexualmente transmissíveis. Além disso, no processamento do leite materno para eliminar ou reduzir a possibilidade de transmissão do HIV via amamentação.
Além de sua ação antiviral, o SDS age em bactérias patogênicas e fungos. SDS elimina os fatores de resistência a medicamentos e resistência sexual de E. coli; e bloqueia o crescimento de numerosas bactérias gramas positivas.
No laboratório
Os SDs se ligam às proteínas que causam sua desnaturação, fornecendo cargas negativas e uma mudança conformacional. Isso permite a determinação de seus pesos moleculares através da eletroforese em poliacrilamida.
SDS também é usado na preparação de amostras de tecido cerebral para uso em microscopia óptica. Também é usado na preparação de amostras de sangue para o número de eritrócitos.
O SDS é usado na purificação de ácidos nucleicos, devido à sua capacidade de dissolver as membranas e sua ação inibitória na atividade das enzimas Arnasa e Dnaasa.
Além disso, o SDS é usado na caracterização de compostos de amônio quaternário.
Aditivo alimentar
SDS é usado como emulsificante e espessamento de alimentos. Melhora a estabilidade e a textura de produtos assados. Além disso, é usado como auxiliar em produtos de ovo seco.
Pode atendê -lo: nitrato de zinco: estrutura, propriedades, obtenção, usosIndústria
O SDS é usado na indústria de galvanoplastia, particularmente níquel e zinco; como removedor de verniz e pintura emulsificante e penetrante; na formulação de explosivos moldados por injeção; e em foguetes sólidos como espuma.
Riscos
A exposição constante do SDS pode causar hiperplasia da pele em porquinhos -da -índia. O coelho e os seres humanos são menos suscetíveis a essas lesões. O contato direto com o SDS em uma concentração ≤ 20%pode causar inflamação moderada e irritação na pele.
Por outro lado, a exposição prolongada à SDS pode produzir dermatite, com sinais de vermelhidão, inchaço e formação de ampolas.
O SDS pode produzir por irritação nos olhos de contato. Também pode ser muito reativo em algumas pessoas e causar irritação na inalação do trato respiratório e desconforto respiratório.
Raramente, a ingestão de SDS pode causar lesões cáusticas. Mas, foi relatado em crianças que ingeriram SDs, vômito profuso de desenvolvimento rápido, depressão do SNC e desconforto respiratório.
Nenhuma evidência de genotoxicidade ou ação teratogênica foi encontrada no SDS. Em 242 pacientes com dermatite eczematosa, foram encontrados 6,4 % dos pacientes com alergia, atribuíveis ao uso de SDS.
Referências
- Dados estruturais de L. PARA. Smith, r. B. Hammond, k. J. Roberts, d. Machin, g. McLeod (2000). Determinação da estratégia cristalina de dodecilsulfato de sódio anidro usando uma combinação de difração de pó de radiação sychrotron e técnicos de modelagem molecular. Journal of Molecular Structure 554 (2-3): 173-182. Doi: 10.1016/S0022-2860 (00) 00666-9.
- Wikipedia. (2019). Dodecilsulfato de sódio. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Dodecilsulfato de sódio. Banco de dados PubChem. CID = 3423265. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Hammouda b. (2013). Efeito de temperatura na nanoestrutura das micelas SDS na água. Journal of Research of the National Institute of Standards and Technology, 118, 151-167. Doi: 10.6028/Jres.118.008
- Elsevier. (2019). Dodecilsulfato de sódio. Ciência direta. Recuperado de: ScientEdirect.com
- Kumar, s., Thejajenuo, j. K. e tsipila, t. (2014). Efeitos toxicológicos do dodecil sulfato de sódio. Journal of Chemical and Pharmaceutical Research 6 (5): 1488 - 1492.
- Rede de dados de toxicologia. (s.F.). Laiuril Sulfato de sódio. Toxnet. Recuperado de: toxnet.Nlm.NIH.Gov
- « Estrutura terciária dos principais recursos das características
- Estrutura de fosfatidilserina, síntese, funções, localização »

