Estrutura secundária de proteínas de características

- 1501
- 267
- Tim Mann
O Estrutura de proteínas secundárias É o nome que define a conformação dobrada localmente de algumas partes da cadeia polipeptídica. Esta estrutura consiste em vários padrões que são repetidos regularmente.
Existem muitas maneiras pelas quais as cadeias de proteínas são dobradas. No entanto, apenas algumas dessas formas são muito estáveis. Na natureza, as formas mais frequentes que as proteínas adquirem são a hélice α, bem como a folha β. Essas estruturas podem ser descritas por ângulos de link ψ (Psi) e φ (Phi) de resíduos de aminoácidos.
 Esquema e modelo de bolas e hastes da hélice alfa de proteínas (estrutura secundária). Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Esquema e modelo de bolas e hastes da hélice alfa de proteínas (estrutura secundária). Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. As interações estabelecidas entre as cadeias laterais de resíduos de aminoácidos podem ajudar a estabilizar ou, pelo contrário, desestabilizar a estrutura secundária das proteínas. A estrutura secundária pode ser observada na constituição de muitas proteínas fibrosas.
[TOC]
História
Na década dos anos 30 do século passado, William Atsbury, trabalhando com raios X, descobriu que a proteína capilar, bem como a dos picos de porcosespina, possuídos em seus segmentos de estrutura que eram repetidos regularmente.
Com base nesses resultados, e com o conhecimento da importância das ligações de hidrogênio na orientação dos grupos polares das ligações peptídicas, William Pauling e Colaboradores, consequentemente eles determinaram hipoteticamente as possíveis conformações regulares que as proteínas poderiam possuir.
Pauling e seus colaboradores, na década de 1950, estabeleceram vários postulados que tiveram que ser cumpridos nos vínculos das cadeias polipeptídicas, incluindo, e em primeiro lugar, que dois átomos não podem se aproximar a uma distância a menos que sua distância de seus respectivos rádios de van der Waals.
Eles também indicaram que são necessários links não -covalentes para estabilizar a dobra das correntes.
Pode atendê -lo: reprodução sexualCom base nesses postulados e conhecimentos anteriores, e usando modelos moleculares, eles conseguiram descrever algumas conformações regulares de proteínas, incluindo, que foram posteriormente demonstraram que eram de natureza mais frequente, como a hélice α e a lâmina β β β β.
Hélice α
É a estrutura secundária mais simples, onde a cadeia polipeptídica é organizada de forma enrolada e compactada em torno de um eixo imaginário. Além disso, as correntes laterais de cada aminoácido se destacam deste esqueleto helicoidal.
Os aminoácidos, neste caso, são organizados de uma maneira que eles tenham ângulos de ligação ψ De -45 ° a -50 ° e φ de -60 °. Esses ângulos se referem à ligação entre o carbono α e o oxigênio do carbonil e a ligação entre o nitrogênio e o carbono α de cada aminoácido, respectivamente.
Além disso, os cientistas determinaram que, para cada curva de hélice α, 3,6 resíduos de aminoácidos são apresentados e que esse turno é sempre dextrogyry em proteínas. Além de ser a estrutura mais simples, a hélice α é a forma predominante em α-queatinas e cerca de 25% dos aminoácidos das proteínas globulares adotam essa estrutura.
A hélice α é estabilizada graças ao fato de apresentar inúmeras pontes de hidrogênio. Assim, três ou quatro links deste tipo são estabelecidos em cada curva de hélice.
Nas pontes de hidrogênio, o nitrogênio de uma ligação peptídica e o átomo de oxigênio do grupo carbonil do aminoácido subsequente interagem, na direção do lado amino-terminal dessa cadeia.
Os cientistas mostraram que uma hélice α pode ser formada com cadeias polipeptídicas formadas por L- ou d-aminoácidos, com a condição de que todos os aminoácidos tenham a mesma configuração de estéreoisômeros. Além.
Pode atendê -lo: imunoglobulina dNo entanto, nem todos os polipeptídeos podem formar uma hélice α estável, porque sua estrutura primária afeta a estabilidade deste. As cadeias R de alguns aminoácidos podem desestabilizar a estrutura, impedindo a formação das hélices α.
Folha β
Na folha β, ou folha β dobrada, cada um dos resíduos de aminoácidos tem uma rotação de 180 ° em relação ao resíduo de aminoácidos anterior. Dessa maneira, é obtido como resultado que o esqueleto da cadeia polipétida é estendido e em um formulário de zigue -zague ou acordeão.
As cadeias polipeptídicas em forma de acordes em guerra podem ser colocadas adjacentes entre si e produzir pontes lineares de hidrogênio entre ambas as correntes.
Duas cadeias polipeptídicas adjacentes podem ser organizadas em paralelo, ou seja, ambas podem ser orientadas na direção amino -carboxil, formando a folha β paralela; o Eles podem ser localizados em direções opostas, depois formando a folha β antiparalla.
As cadeias laterais de resíduos de aminoácidos adjacentes se destacam do esqueleto da corrente em direções opostas, dando origem a um padrão alternado. Algumas estruturas de proteínas limitam os tipos de aminoácidos de estruturas β.
Por exemplo, em proteínas densamente embaladas, aminoácidos de cadeia curta, como glicina e alanina em suas superfícies de contato, são mais frequentes.
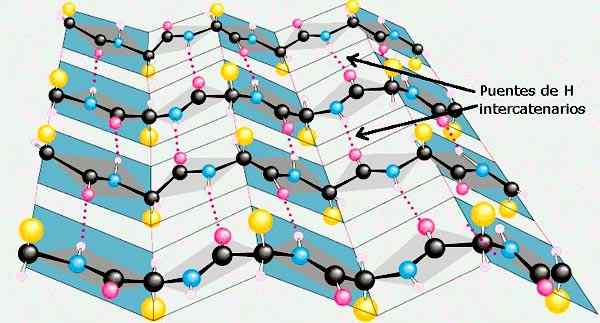 A folha β das estruturas secundárias de proteínas. Tomado e editado de: Preston Manor School + JFL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
A folha β das estruturas secundárias de proteínas. Tomado e editado de: Preston Manor School + JFL [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Outras conformações da estrutura secundária
Helix 310
Esta estrutura é caracterizada por apresentar 3 resíduos de aminoácidos por rodada. Essa estrutura foi observada em algumas proteínas, mas não é de natureza muito frequente.
Helix π
Enquanto isso, essa estrutura tem 4,4 resíduos de aminoácidos a partir da virada em espiral e um loop de ligação de hidrogênio de 16 elementos. Embora essa configuração seja estericamente possível, ela nunca foi observada na natureza.
Pode servir a você: Agar de Potato de Dextrose: Fundação, Preparação e UsoA possível causa disso pode ser seu centro oco, grande demais para permitir o desempenho das forças de van der Waals que ajudariam a estabilizar a estrutura e, no entanto, é muito pequena para permitir a passagem de moléculas de água.
Estrutura de Superscundaria
Estruturas supercuisas são combinações de estruturas secundárias de α e folhas β β β β folhas de β β. Essas estruturas podem ocorrer em muitas proteínas globulares. Existem diferentes combinações possíveis, cada uma com características particulares.
Alguns exemplos de estruturas de superecundários são: o unidade βαβ, no qual duas folhas β paralelas são ligadas por um segmento de hélice α; o unidade αα, caracterizado por dois αICes sucessivos, mas separados por um segmento não -helical, associado à compatibilidade de suas cadeias laterais.
Várias folhas β podem recuar por si mesmo, dando uma configuração de barril β, enquanto uma folha β antipaallala se retirou se constitui uma estrutura de supercundaria chamada Chave grega.
Referências
- C.K. Mathews, k.E. Van hold & k.G. Ahern (2002). Bioquímica. 3ª edição. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, p. Mayes, d.C. Granner & V.C. Rodwell (1996). Bioquímica de Harper. Appleton & Lange.
- J.M. Berg, j.eu. Tymoczko & l. Stryer (2002). Bioquímica. 5ª edição. C. H. Freeman and Company.
- J.Koolman & k.-H. Roehm (2005). Atlas de cor bioquímica. 2ª edição. Thieme.
- PARA. Lehninger (1978). Bioquímica. Omega Editions, S.PARA.
- T. McKee & J.R. McKee (2003). Bioquímica: a base molecular da vida. 3Rd Edição. A McGraw-Hiii Companies, Inc.
- « Choques elásticos em uma dimensão, casos especiais, exercícios
- Características do valor atual, fórmulas e exemplos »

