LEWIS estrutura em que consiste, como é feito, exemplos

- 1933
- 537
- Tim Mann
O Estrutura de Lewis É tudo o que a representação de ligações covalentes dentro de uma molécula ou um íon. Nele, esses títulos e elétrons são representados com pontos longos ou scripts, embora na maioria das vezes os pontos correspondam aos elétrons não compartilhados e aos scripts para as ligações covalentes.
Mas o que é um link covalente? É o compartilhamento de alguns elétrons (ou pontos) entre dois átomos da tabela periódica. Com esses diagramas, você pode esboçar muitos esqueletos para um determinado composto. Qual deles é o certo dependerá das cargas formais e da natureza química dos mesmos átomos.
 Composto de 2-bromopropano. Por Ben Million [Domínio Público], da Wikimedia Commons.
Composto de 2-bromopropano. Por Ben Million [Domínio Público], da Wikimedia Commons. Na imagem superior, há um exemplo do que é uma estrutura de Lewis. Nesse caso, o composto representado é 2-bromopropano. Os pontos pretos correspondentes aos elétrons podem ser vistos, tanto aqueles que participam dos links quanto aqueles que não são compartilhados (o único torque logo acima do BR).
Se os pontos dos pontos ":" fossem substituídos por um script longo "-", então o esqueleto de carbono do 2-bromopropano seria representado como: C-C-C-C. Por que, em vez da "moldura molecular" desenhada, poderia ser c-h-h-c? A resposta está nas características eletrônicas de cada átomo.
Assim, como o hidrogênio tem apenas um elétron e um único orbital disponível para preencher, apenas uma ligação covalente. Portanto, você nunca pode formar duas ligações (não confundindo com pontes de hidrogênio). Por outro lado, a configuração eletrônica do átomo de carbono permite (e demandas) a formação de quatro ligações covalentes.
Por esse motivo, as estruturas de Lewis onde C e H devem ser consistentes e respeitar o que é governado por suas configurações eletrônicas. Dessa forma, se o carbono tiver mais de quatro ligações, ou hidrogênio mais de um, o esboço pode ser descartado e iniciar um novo mais alinhado com a realidade.
É aqui que algumas das principais razões ou costas dessas estruturas aparecem, introduzidas por Gilbert Newton Lewis em sua busca por representações moleculares fiéis a dados experimentais: a estrutura molecular e as cargas formais.
Todos os compostos existentes podem ser representados pelas estruturas de Lewis, dando uma primeira abordagem de como a molécula ou íons pode ser.
[TOC]
Qual é a estrutura de Lewis?
É uma estrutura representativa de elétrons de Valência e ligações covalentes em uma molécula ou íon que serve para ter uma idéia de sua estrutura molecular.
No entanto, essa estrutura falha em prever alguns detalhes importantes, como geometria molecular em relação a um átomo e seus arredores (se for quadrado, plano, bipiramidal, etc.).
Também não diz nada sobre qual é a hibridação química de seus átomos, mas onde as duplas ou ligações triplas são colocadas e se houver ressonância na estrutura.
Com essas informações, você pode discutir sobre a reatividade de um composto, sua estabilidade, como e qual mecanismo a molécula seguirá ao reagir.
Por esse motivo.
Como se faz?
Para desenhar ou esboçar uma estrutura, fórmula ou diagrama de Lewis, a fórmula química do composto é essencial. Sem ele, você nem consegue saber quais são os átomos que compensam. Uma vez com ele, a tabela periódica é usada para localizar quais grupos pertencem.
Pode servir a você: viscosidade: exemplos, causas, unidades, tiposPor exemplo, se você tiver composto C14QUALQUER2N3 Então teríamos que procurar os grupos onde o carbono, oxigênio e nitrogênio são. Fiz isso, independentemente do composto, o número de elétrons de valência permanece o mesmo, tão cedo ou mais tarde eles memorizam.
Assim, o carbono pertence ao grupo IVA, oxigênio ao grupo e nitrogênio ao VA. O número do grupo é igual à quantidade de elétrons (pontos) de Valência. Todos eles têm em comum a tendência de completar o octeto da camada de Valência.
Qual é a regra do octeto?
Isso diz que há uma tendência de átomos para completar seu nível de energia com oito elétrons para alcançar a estabilidade. Isso se aplica a todos os elementos não metálicos ou aos encontrados em blocos s ou p da tabela periódica.
No entanto, nem todos os elementos obedecem à regra do octeto. Casos particulares são metais de transição, cujas estruturas são mais baseadas em cargas formais e seu número de grupo.
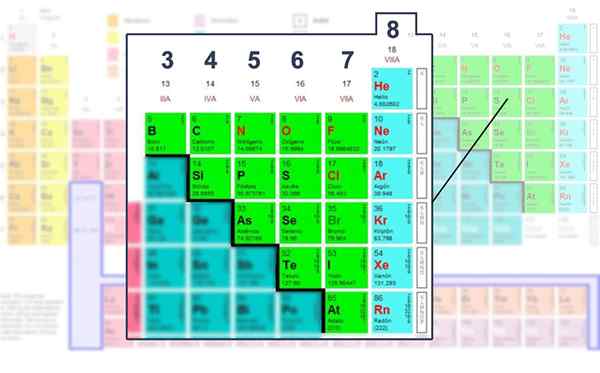 Número de elétrons da camada de Valência dos elementos não metálicos, aqueles em que pode ser operado com a estrutura de Lewis.
Número de elétrons da camada de Valência dos elementos não metálicos, aqueles em que pode ser operado com a estrutura de Lewis. Aplicando a fórmula matemática
Sabendo qual grupo os elementos pertencem e, portanto, o número de elétrons de valência disponíveis para formar links, a seguinte fórmula é feita, o que é útil para desenhar as estruturas de Lewis:
C = N - D
Onde C significa elétrons compartilhados, isto é, aqueles que participam dos títulos covalentes. Como cada link é composto de dois elétrons, C/2 é igual ao número de links (ou scripts) que devem ser desenhados.
N são os elétrons necessários, Aqueles que devem ter o átomo em sua camada de Valência são isoletrônicos para o gás nobre que se segue no mesmo período. Para todos os elementos que não sejam H (já que exige que dois elétrons sejam comparados a ele), eles precisam de oito elétrons.
D são os elétrons disponíveis, que são determinados pelo grupo ou número de elétrons de valência. Assim, como o CL pertence ao Grupo VIIa, deve estar cercado por sete pretos ou elétrons e lembre -se de que um casal é necessário para formar um link.
Tendo os átomos, seus pontos e o número de links c/2, uma estrutura de Lewis pode ser improvisada. Mas, além disso, é necessário ter noção de outras "regras".
Onde colocar os átomos menos eletronegativos
Os átomos menos eletronegativos na grande maioria das estruturas ocupam os centros. Por esse motivo, se você tem um composto com átomos de P, O e F, o P deve, portanto, estar no centro da estrutura hipotética.
Também é importante destacar que os hidrogênios geralmente estão ligados a átomos muito eletronegativos. Se você tem em um zn, h e o composto, o h irá ao lado do O e não com o Zn (Zn-O-H e não H-Zn-O). Existem exceções a essa regra, mas geralmente ocorre com átomos não -metálicos.
Simetria e cargas formais
A natureza tem uma alta preferência por causar estruturas moleculares o mais simétricas possível. Isso ajuda a evitar a criação de estruturas desordenadas, com os átomos dispostos de tal maneira que eles não obedecem a nenhum padrão aparente.
Pode servir a você: teorias ácidas: Arrhenius, Bronsted-Lowry, LewisPor exemplo, para o composto C2PARA3, Onde A é um átomo fictício, a estrutura mais provável seria A-C-a-C-A. Observe a simetria de seus lados, ambos os reflexos do outro.
Cargas formais também desempenham um papel importante ao desenhar as estruturas de Lewis, especialmente para íons. Assim, os links podem ser adicionados ou removidos para que a carga formal de um átomo corresponda à carga total exibida. Este critério é muito útil para os compostos de metais de transição.
Limitações na regra do octeto
 Representação de trifluoreto de alumínio, um composto que é instável. Ambos os elementos são compostos por seis elétrons, o que gera três ligações covalentes, quando devem ter oito para alcançar a estabilidade. Fonte: Gabriel Bolívar
Representação de trifluoreto de alumínio, um composto que é instável. Ambos os elementos são compostos por seis elétrons, o que gera três ligações covalentes, quando devem ter oito para alcançar a estabilidade. Fonte: Gabriel Bolívar Nem todas as regras são cumpridas, o que não significa necessariamente que a estrutura está incorreta. Exemplos típicos disso são observados em muitos compostos em que elementos do grupo IIIa (B, Al, Ga, IN, TL) estão envolvidos. Aqui é especificamente considerado trifluoruro de alumínio (ALF3).
Em seguida, aplicando a fórmula descrita acima, você tem:
D = 1 × 3 (um átomo de alumínio) + 7 × 3 (três átomos de fluorina) = 24 elétrons
Aqui em 3 e 7 são os respectivos grupos ou números de elétrons de valência disponíveis para alumínio e fluoreto. Então, considerando os elétrons necessários n:
N = 8 × 1 (um átomo de alumínio) + 8 × 3 (três átomos de fluorina) = 32 elétrons
E, portanto, os elétrons compartilhados são:
C = N - D
C = 32 - 24 = 8 elétrons
C/2 = 4 links
Como o alumínio é o átomo menos eletronegativo, ele deve ser colocado no centro, e o flúor forma apenas um link. Considerando isso, você tem a estrutura Lewis del Alf3 (Imagem superior). Os elétrons compartilhados são destacados com pontos verdes para distingui -los dos não comparados.
Embora os cálculos prevejam que existem 4 links que devem ser formados, o alumínio carece de elétrons suficientes e também não há quarto átomo de flúor. Como resultado, o alumínio não cumpre a regra do octeto e esse fato não se reflete nos cálculos.
Exemplos de estruturas de Lewis
Iodo
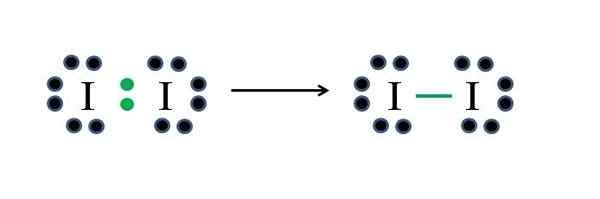 Os não -metais do iodo têm sete elétrons cada, então, compartilhando um desses elétrons cada, eles geram uma ligação covalente que lhes dá estabilidade. Fonte: Gabriel Bolívar
Os não -metais do iodo têm sete elétrons cada, então, compartilhando um desses elétrons cada, eles geram uma ligação covalente que lhes dá estabilidade. Fonte: Gabriel Bolívar O iodo é um halogênio e, portanto, pertence ao grupo VIIA. Em seguida, possui sete elétrons de Valência, e esta molécula diatômica simples pode ser representada improvisando ou aplicando a fórmula:
D = 2 × 7 (dois átomos de iodo) = 14 elétrons
N = 2 × 8 = 16 elétrons
C = 16 - 14 = 2 elétrons
C/2 = 1 link
Como 14 elétrons 2 participam da ligação covalente (pontos verdes e script), 12 permanecem como não compartilhados; E como são dois átomos de iodo, 6 devem ser distribuídos para um deles (seus elétrons de valência). Nesta molécula, apenas essa estrutura é possível, cuja geometria é linear.
Amônia
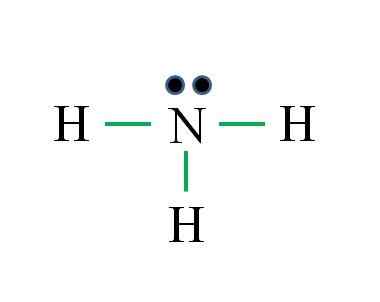 O nitrogênio possui 5 elétrons, enquanto o hidrogênio apenas 1. O suficiente para alcançar a estabilidade quando três ligações covalentes são estabelecidas, compostas por um elétron de n e outra fonte H: Gabriel Bolívar
O nitrogênio possui 5 elétrons, enquanto o hidrogênio apenas 1. O suficiente para alcançar a estabilidade quando três ligações covalentes são estabelecidas, compostas por um elétron de n e outra fonte H: Gabriel Bolívar Qual é a estrutura de Lewis para a molécula de amônia? Como o nitrogênio é do grupo VA, possui cinco elétrons de Valência e depois:
Pode servir a você: Termômetro de laboratório: características, para que serve, uso, exemplosD = 1 × 5 (um átomo de nitrogênio) + 1 × 3 (três átomos de hidrogênio) = 8 elétrons
N = 8 × 1 + 2 × 3 = 14 elétrons
C = 14 - 8 = 6 elétrons
C/2 = 3 links
Desta vez, a fórmula está certa com o número de links (três links verdes). A partir dos 8 elétrons disponíveis 6 participam das ligações, há um torque não -compartilhado localizado acima do átomo de nitrogênio.
Esta estrutura diz tudo o que deve ser conhecido da base de amônia. Aplicando o conhecimento de Tev e TRPEV, segue -se que a geometria é tetraédrica distorcida pelo torque livre de nitrogênio e que a hibridação disso é, portanto, SP3.
C2H6QUALQUER
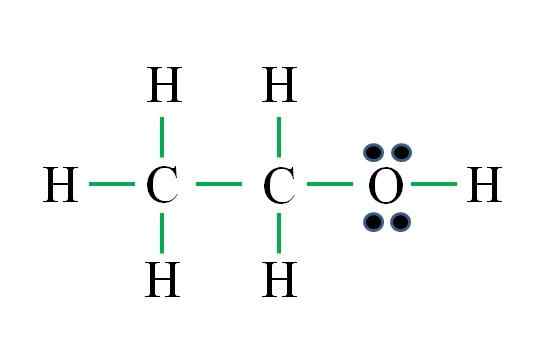 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar A fórmula corresponde a um composto orgânico. Antes de aplicar a fórmula, deve -se lembrar que os hidrogênios formam uma única ligação, oxigênio dois, carbono quatro e que a estrutura deve ser o mais simétrica possível. Proceder como os exemplos anteriores são:
D = 6 × 1 (seis átomos de hidrogênio) + 6 × 1 (um átomo de oxigênio) + 4 × 2 (dois átomos de carbono) = 20 elétrons
N = 6 × 2 (seis átomos de hidrogênio) + 8 × 1 (um átomo de oxigênio) + 8 × 2 (dois átomos de carbono) = 36 elétrons
C = 36 - 20 = 16 elétrons
C/2 = 8 links
O número de scripts verdes corresponde aos 8 links calculados. A estrutura proposta de Lewis é a do etanol ch3CH2Oh. No entanto, também teria sido correto propor a estrutura do éter dimetílico3OCH3, o que é ainda mais simétrico.
Qual dos dois está "mais" correto? Ambos são igualmente, uma vez que as estruturas surgiram como isômeros estruturais da mesma fórmula molecular C2H6QUALQUER.
Íon permanganato
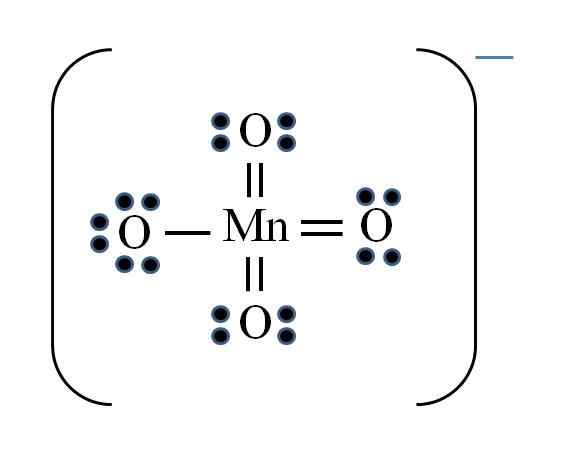 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar A situação é complicada quando você deseja fazer estruturas de Lewis para compostos de metal de transição. O manganês pertence ao grupo VIIB também, o elétron da carga negativa deve ser adicionado entre os elétrons disponíveis. Aplicando a fórmula que você tem:
D = 7 × 1 (um átomo de manganês) + 6 × 4 (quatro átomos de oxigênio) + 1 elétron por carga = 32 elétrons
N = 8 × 1 + 8 × 4 = 40 elétrons
C = 40 - 32 = 8 elétrons compartilhados
C/2 = 4 links
No entanto, os metais de transição podem ter mais de oito elétrons em Valencia. Além disso, para o íon mno4- Exibe a carga negativa, é necessário reduzir as cargas formais de átomos de oxigênio. Como? Através dos links duplos.
Se todos os links do MNO4- Eles eram simples, as cargas formais do oxigênio seriam iguais a -1. Como existem quatro, a carga resultante seria -4 para ânion, o que obviamente não é verdadeiro. Quando as ligações duplas são formadas, é garantido que um único oxigênio tenha uma carga formal negativa, refletida no íon.
No íon permanganato, pode -se ver que há ressonância. Isso implica que o único link simples do Mn-O é democalizado entre os quatro átomos de O.
Íon dicromato
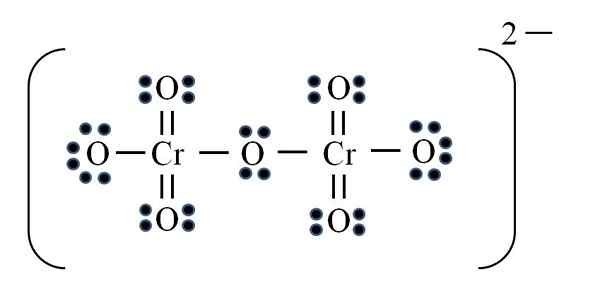 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Finalmente, um caso semelhante ocorre com o íon dicromato (CR2QUALQUER7). O Chrome pertence ao grupo VIB, por isso possui seis elétrons de Valencia. Aplicando a fórmula novamente:
D = 6 × 2 (dois átomos de cromo) + 6 × 7 (sete átomos de oxigênio) + 2 elétrons pela carga divalente = 56 elétrons
N = 8 × 2 + 8 × 7 = 72 elétrons
C = 72 - 56 = 16 elétrons compartilhados
C/2 = 8 links
Mas não há 8 links, mas 12. Pelas mesmas razões encontradas, no íon permanganato, dois oxigênio devem ser deixados com cargas formais negativas que adicionam igual a -2, a carga do íon dicromato.
Assim, como muitos links duplos são adicionados conforme necessário. Dessa forma, você chega à estrutura de Lewis da imagem para o CR2QUALQUER72-.
Referências
- Whitten, Davis, Peck e Stanley. Química. (8ª ed.). Cengage Learning, p. 251.
- Estruturas de Lewis. Retirado de: Chemed.Chem.Purdue.Edu
- Steven a. Hardinger, Departamento de Química e Bioquímica, UCLA. (2017). Estrutura de Lewis. Tirado de: química.UCLA.Edu
- Wayne Breslyn. (2012). Desenho de estruturas de Lewis. Retirado de: Terpconnect.Umd.Edu
- Webmaster. (2012). Lewis ("Electron Dot") estruturas. Departamento de Química, Universidade do Maine, Orono. Retirado de: Química.Umeche.Maine.Edu
- Lancaster, Sean. (25 de abril de 2017). Como determinar quantos pontos estão na estrutura do ponto Lewis de um elemento. Cienting. Recuperado de: cienting.com
- « Características e exemplos da administração privada
- Aprendendo as principais características e autores »

