Pauling Scale

- 2150
- 396
- Gilbert Franecki
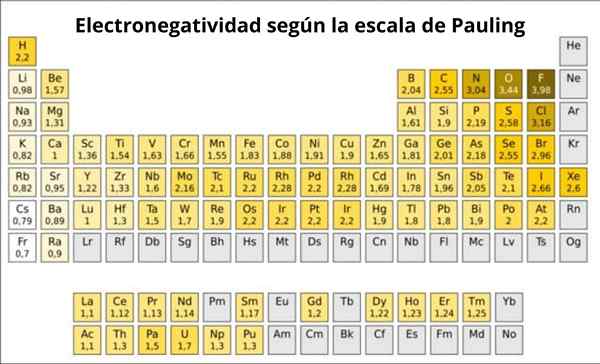 figura 1. Pauling Scale. Fonte: Wikimedia Commons.
figura 1. Pauling Scale. Fonte: Wikimedia Commons. Qual é a escala Pauling?
O Pauling Scale É uma escala arbitrária usada em química para expressar o Eletro-negatividade dos elementos. Isso é definido como a tendência de um certo átomo de atrair elétrons quando combinado com outro átomo.
Nesse sentido, os elementos de alta eletronegatividade tendem a ganhar elétrons facilmente. Estes não são metais, embora, por sua vez, menos eletronegativos, como metais, é mais fácil para eles produzir elétrons.
Portanto, conhecer a eletronegatividade de um elemento tem uma idéia do tipo de link capaz de se formar quando combinado com outro. Veremos isso com um exemplo numérico mais tarde.
Com essas informações, você pode prever muitas das propriedades que um composto terá, algo muito útil em química experimental e para a ciência dos materiais, onde novos compostos estão sendo criados continuamente.
No entanto, é conveniente esclarecer que, apesar da importância, não existe uma maneira única de determinar a eletronegatividade; A escala Pauling é apenas uma das várias formas propostas para encontrá -la, embora seja uma das mais usadas.
De fato, Pauling's é uma escala arbitrária na qual um valor numérico é atribuído a cada elemento da tabela periódica, que reflete sua eletronegatividade. Vemos isso na Figura 1, onde você tem a eletronegatividade de cada elemento, como foi atribuído pelo Prêmio Nobel duas vezes Linus Pauling (1901-1994) por volta de 1939.
A eletronegatividade dos elementos
Pauling, ao lado de Don M. Yost, encontrou os valores de eletronegatividade empiricamente, através de dados experimentais obtidos medindo a energia do link.
Pauling atribuído ao Fluorine.0. Portanto, quando o fluoreto forma links, ele exibe a tendência mais alta para atrair elétrons entre todos os elementos.
Pode servir a você: Número de coordenação: o que é, cálculo, exemplosSegundo é oxigênio, com 3.5 e terceiro é nitrogênio com 3.0. Ambos estão localizados acima e à direita da mesa.
Por outro lado, na extremidade oposta, o elemento menos eletronegativo é o césio, cujo símbolo é CS, localizado à esquerda da tabela, que Pauling atribuiu o número 0.7.
Eletronegatividade na tabela periódica
Em geral e como observado na Figura 1, a eletronegatividade - e a energia de ionização - aumenta da esquerda para a direita na tabela periódica. A tendência geral também indica uma diminuição ao passar de cima para baixo.
Portanto, os elementos mais eletronegativos os terão no ângulo reto superior da mesa: fluorina, oxigênio, cloro, nitrogênio. O menos eletronegativo -ou o mais eletropositivo se for preferido -estará à esquerda: lítio, sódio, potássio e outros elementos do grupo 1 -a coluna da extrema esquerda, correspondente a metais alcalinos e alcalinos-.
Em cada coluna, a eletronegatividade diminui aumentando o número atômico do elemento, exceto em metais de transição no centro, que não seguem essa tendência.
Um ponto importante a destacar é que a eletronegatividade é relativa, não é uma propriedade invariável de cada elemento e é medida apenas em relação à de outros elementos. Depende muito do estado de oxidação, para que o mesmo elemento possa exibir eletronegatividade diferente, dependendo do tipo de composto que se forma.
Link Diferença de energia
 Figura 2. O químico americano Linus Pauling em 1955. Fonte: Wikimedia Commons.
Figura 2. O químico americano Linus Pauling em 1955. Fonte: Wikimedia Commons. Na química, um link é a maneira pela qual os átomos são unidos, o mesmo ou diferente, para formar moléculas. Entre os átomos estão forças que os mantêm juntos estáveis.
Existem vários tipos de link, mas dois são considerados aqui:
- Covalente, em que átomos de eletronegatividades semelhantes compartilham alguns elétrons.
- Iônico, frequente entre átomos com diferentes eletronegatividades nas quais a atração eletrostática prevalece.
Suponha que dois elementos A E B possam formar moléculas entre si, denotados aa e bb. E eles também podem se juntar para formar um composto AB, em todo o tipo de link.
Graças à participação de forças intermoleculares, há energia no link. Por exemplo, a energia no link AA é eAa, No link BB está eco e finalmente em composto AB é eAb.
Se a molécula AB for formada por uma ligação covalente, teoricamente a energia do link é a média das energias eAa e eBb:
EAb = ½ (eAa + EBb)
Pauling calculado eAb Para vários compostos, mediu -o experimentalmente e determinou a diferença entre os dois valores, que chamou de δ:
Δ = | (eAb) medido - (eAb) Teórico | = | (EAb) medido - ½ (eAa + EBb) |
Pauling argumentou assim: se δ estiver muito próximo de 0, significa que as eletronegatividades de ambos os elementos são semelhantes e o link que os une é covalente. Mas se δ não for pequeno, então a ligação entre A e B não é pura covalente.
Quanto maior o valor absoluto de δ, maior a diferença entre a eletronegatividade dos elementos A e B e, portanto, o link de que une será do tipo iônico. Posteriormente, o leitor encontrará um exemplo em que, calculando δ, é possível determinar o tipo de link de um composto.
Equações para eletronegatividade
A partir do fato de que a diferença de energia é o sinal que distingue a natureza do vínculo, Pauling fez muitos experimentos que o levaram a criar uma expressão empírica para a relativa eletronegatividade de dois elementos para E B que formam uma molécula.
Ao denotar a eletronegatividade como χ (letra grega "chi"), Pauling definiu Δ da seguinte forma:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√δ
Pode servir a você: Equilíbrio de Tanteo: etapas, exemplos e exercíciosObserve que δ é uma quantidade positiva. Fatia f = 0.102 que aparece multiplicando a raiz quadrada de δ é o fator de conversão entre KJ (Kilojoules) e EV (Electron-Volt), ambas as unidades de energia.
Se, em vez disso, são usados quilocalororias e volts elétrons, a diferença de eletronegatividades é expressa com uma fórmula semelhante, mas com f = 0.208:
χ (a) - χ (b) = 0.208 paredes
Pauling começou a atribuir hidrogênio o valor de 2.1, um valor anterior obtido pelo químico Robert Mulliken. Ele escolheu esse elemento como ponto de partida porque forma links covalentes com muitos outros.
Através da equação anterior, ele continuou atribuindo valores relacionados ao restante dos elementos. Ele percebeu que a eletronegatividade aumenta quando se move da esquerda para a direita e de cima para baixo na tabela periódica, conforme descrito na seção anterior.
Exemplo
Abaixo está uma lista de elementos: N, J e M e suas respectivas eletronegatividades χ de acordo com a escala Pauling:
-N: Χ = 4.0
-J: Χ = 1.5
-E: Χ = 0.9
-M: Χ = 1.6
Entre os seguintes compostos formados com eles:
Yj, yn, mn e jm
Apontar aquele com o maior caráter iônico e que cuja natureza é covalente. Raciocine sua resposta.
Solução
De acordo com os critérios estabelecidos por Pauling, o composto com o caráter iônico mais alto será o que é a maior diferença entre eletronegatividades e, portanto, um maior valor de δ. Por sua parte, o composto com a menor diferença de energia é o que tem uma ligação covalente.
Em seguida, calcularemos quanto δ vale para cada composto, como segue:
Composto yj
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Composto yn
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Composto mn
Δ = [χ (M) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
JM composto
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
A partir dos resultados acima, segue -se que o composto de caráter iônico é o yn, cujo δ = 9.61, enquanto o composto de caráter covalente é o JM, com Δ = 0.01.

