Equilíbrio de vapor líquido

- 4995
- 1337
- Melvin Mueller
O que é equilíbrio de vagador líquido?
Ele Equilíbrio de vapor líquido É um estado dinâmico que estabelece um líquido, seja uma substância pura ou uma mistura, com o vapor que circunda e interage com sua superfície. Para ocorrer, o recipiente deve ser fechado, caso contrário, as correntes de ar levariam o líquido a evaporar lentamente.
Quando o sistema é fechado, a pressão exercida por moléculas de fase a vapor estará subindo com o passar do tempo. Chegará um ponto onde a pressão vai parar; Essa é a pressão de vapor do líquido, que é uma propriedade física da questão, sendo independente do tamanho do contêiner ou do volume de líquido.
 Quando uma bebida a gás é descoberta, seu equilíbrio de vapor líquido é perturbado, causando um desequilíbrio das pressões fora e dentro da garrafa, e com ela o bubb. Fonte: OpenStax, CC por 4.0, via Wikimedia Commons
Quando uma bebida a gás é descoberta, seu equilíbrio de vapor líquido é perturbado, causando um desequilíbrio das pressões fora e dentro da garrafa, e com ela o bubb. Fonte: OpenStax, CC por 4.0, via Wikimedia Commons Todo líquido, puro ou misto, terá uma pressão de vapor associada que dependerá da volatilidade de seus componentes; E, portanto, das forças intermoleculares que as mantêm juntas dentro do líquido e em sua superfície.
Essa pressão pode ser descrita assumindo a idealidade das soluções ou a miscibilidade dos componentes de uma mistura. Para fazer isso, o uso de diagramas binários é muito útil, no qual é possível contemplar a viabilidade de um processo de separação.
O equilíbrio do vapor líquido é essencial para infinitos de processos de engenharia química, como destilações fracionárias e feitas com vapor de água, através do qual destilados destilados nos componentes mais voláteis são obtidos. Este é o caso do etanol aos 95.4% na água, sendo a porcentagem de álcool mais acessível e econômica no mercado.
Substâncias puras
As moléculas de uma substância pura não estão paradas, mas passam de um lugar para outro, graças a uma energia cinética intrínseca. Às vezes, essa energia pode ser grande o suficiente para superar as forças intermoleculares que "puxam" uma molécula de particular para o seio do líquido. Então, a molécula escapará da superfície do líquido para a fase de vapor.
Na fase a vapor, as moléculas colidirão com as paredes internas do recipiente, vencendo ou perdendo velocidade até se reunir com a superfície do líquido, onde uma vez que eles vão integrar o conglomerado de moléculas da fase líquida.
Pode atendê -lo: cobalto: estrutura, propriedades, aplicaçõesAssim, o tempo vai até, a uma certa temperatura (para dizer 25 ° C), o número de moléculas que escapam da superfície é igual àquelas que entram do vapor. Diz-se, portanto, que um equilíbrio de vapor líquido foi estabelecido em uma substância pura para.
A pressão de vapor para experimentar as paredes internas do recipiente, bem como a superfície do líquido, será igual a PPARAº, que é constante e reproduzível; Independentemente de quão grande ou pequeno seja o recipiente nem o volume do líquido considerado.
Misturas
Nas misturas líquidas, também haverá um componente que exerce pressão na superfície líquida e contornos de contêineres. Sua pressão de vapor, como pode ser esperado, será composta de contribuições de cada um dos componentes da mistura, para dizer, duas substâncias a e b. Essas misturas podem ser miscíveis, parcialmente miscíveis.
Miscível
Em uma mistura miscível entre A e B, ambas as substâncias compõem uma única fase, que à primeira vista parece uma substância pura. Assim, de acordo com a lei de Dalton, a pressão da mistura ou solução será igual a:
Psol = PPARA + PB +··· pYo
Sendo pYo qualquer outro componente que também esteja presente na mistura. Observe que pPARA≠ pPARAº, isto é, as pressões das substâncias na mistura não são as mesmas que as de seus estados de alta pureza.
Ao assumir que a solução é ideal, as diferenças entre as interações A-A, B-B e A-B são óbvias. Isso pode ser aplicado, por exemplo, em uma mistura de etanol e metanol.
Portanto, as pressões de vapor dos componentes na mistura dependerão de suas quantidades relativas na fase líquida, expressas como frações molares xYo. E é aqui que a lei de Raault intervém, que procura relacionar a pressão pPARA E PPARAº:
PPARA = XPARA PPARAº
Sendo agora a pressão total igual a:
Psol = XPARA PPARAº + xB PBº +···
A fase a vapor, por outro lado, terá suas próprias composições, expressas como frações molares de Yi:
Yi = pYo / Psol
= XYo PYoº / psol
Diagrama binário
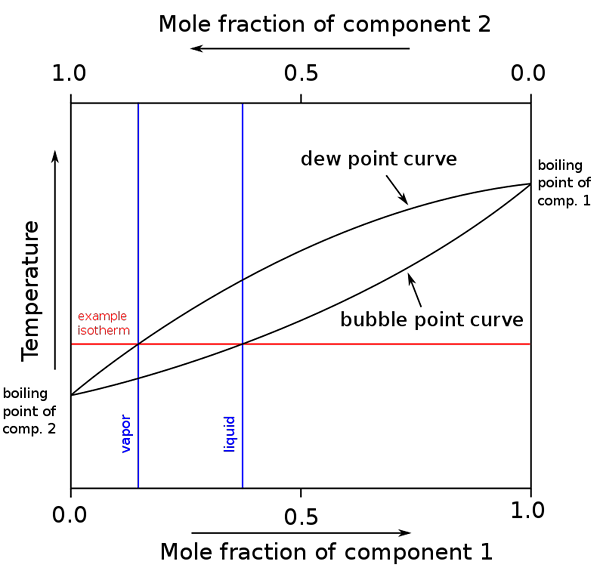 Diagrama de pontos de ebulição e composições molares para uma mistura binária. Fonte: binary_boiling_point_diagram.PNG: H PADleckasderivative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons
Diagrama de pontos de ebulição e composições molares para uma mistura binária. Fonte: binary_boiling_point_diagram.PNG: H PADleckasderivative Work: Michbich, CC BY-SA 2.5, via Wikimedia Commons Quando as frações molares dos componentes de uma mistura binária (a + b) são gráficas, dependendo da temperatura ou pressão, são obtidos diagramas binários (veja acima). Esta forma em particular, a mais simples, corresponde à das soluções ideais.
Pode servir a você: volume molar: conceito e fórmula, cálculo e exemplosA área acima do "oval" corresponde à fase de vapor, enquanto a área abaixo corresponde à fase líquida da mistura. Observe que quando a fração molar do componente 1 é 0 (x1= 0), a fração molar do componente 2 ou B será igual a 1 (x2= 1) e então a pressão do vapor deve apenas B. Esta temperatura se torna o ponto de ebulição de B.
Enquanto isso, na outra extremidade (à direita), quando x2= 0 mas x1= 1, a pressão do vapor é apenas. Esta temperatura se torna a de seu ponto de ebulição.
A linha oval inferior corresponde ao ponto da bolha, que é quando a primeira bolha aparece quando a mistura líquida é aquecida (subindo o diagrama). E a linha superior corresponde ao ponto de orvalho, que é quando a fase de vapor esfria e a primeira gota aparece (descendo no diagrama).
Azeotropos
Em muitas soluções não ideais, teremos azeotrops, que são misturas que evaporam a manutenção de sua composição constante; isto é, eles evaporam como se fossem um composto puro.
É impossível "quebrar" uma composição azeotrópica através de mais etapas de destilação. Em vez disso, outros métodos são usados para aumentar a pureza do componente desejado.
Por exemplo, a mistura de etanol-água forma um azeotrópico com uma composição 95.4 de etanol. Isso significa que é impossível, através de destilações, obter um etanol com uma concentração maior que 95.4%; Sempre haverá 4.6% de água restante. Se você quisesse preparar etanol absoluto (100%), seria necessário usar materiais desidratados ou outras rotas de síntese.
Em um diagrama binário, podemos ver a presença de um azeotrópio, que apresenta a seguinte forma:
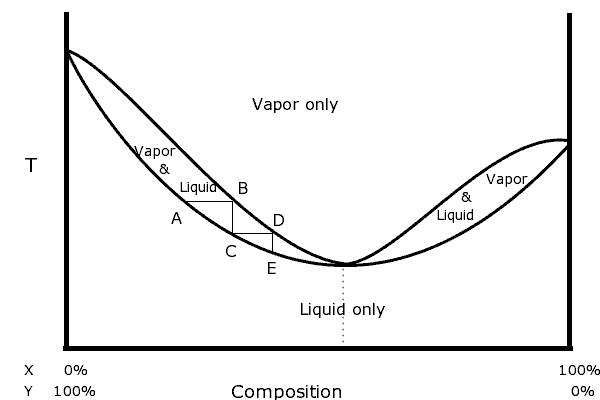 Diagrama binário de uma mistura com azeotrópico positivo. Fonte: Karlhahn na Wikipedia inglesa, domínio público, via Wikimedia Common
Diagrama binário de uma mistura com azeotrópico positivo. Fonte: Karlhahn na Wikipedia inglesa, domínio público, via Wikimedia Common À esquerda do diagrama, pode-se observar que dentro do "oval", uma região em que temos o equilíbrio do vapor líquido, podemos destilar em etapas consecutivas (a, b, c, d e e) para obter um cada vez mais rico mistura no componente mais volátil (x para este diagrama).
No ponto azeotrópico, no entanto, a mistura x e y e fervura como se fosse uma única substância, por isso não importa quantas destilações sejam feitas, tanto o líquido quanto o vapor terão a mesma composição.
Pode servir a você: fórmula molecular: como eliminá -lo, exemplos e exercíciosParcialmente miscível
Nas misturas parcialmente miscíveis, elas serão formadas, dependendo da temperatura, duas fases reconhecíveis: uma rica em componente A e outra rica em componente B. Os diagramas binários para esses casos são muitos mais rigorosos e amplos, pois envolvem regiões onde o vapor coexiste junto com as duas fases.
Imiscível
Ao falar sobre misturas imiscíveis, cada componente se comportará como se estivesse em um estado de alta pureza, pois mal interage com as outras moléculas. Portanto, a pressão do vapor para essas misturas será igual a:
Psol = PPARAº + pBº +··· PYoº
A mistura ferverá a uma temperatura menor que a dos componentes puros, porque a pressão da mistura imiscível será maior, pois é igual à soma das pressões de cada componente em seu estado puro. Mais pressão do vapor implica que é mais volátil e, portanto, ferverá a uma temperatura mais baixa.
Formulários
Destilações
Em destilações, especialmente no nível industrial, o conhecimento sobre o equilíbrio de vapor líquido é primário. A partir dos componentes da mistura e de seus diagramas de fase, pode -se calcular quantos pratos são necessários na construção de uma torre de fracionamento para a separação correta dos referidos componentes.
Destilação de vapor de água
Vapor de água pode ser bombeado dentro de uma mistura sob destilação. Ao borbulhar o vapor de água dentro do líquido, a pressão de vapor da mistura será aumentada, por isso ferverá a uma temperatura mais baixa e ajudará a extrair os componentes mais voláteis (como essências).
Bebendo pássaro
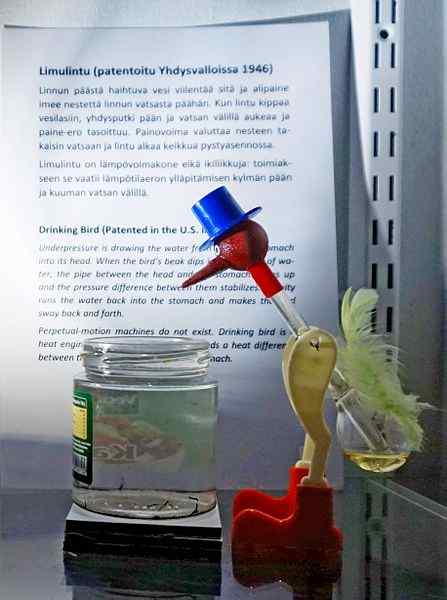 Bebendo pássaro, um dos brinquedos mais engenhosos de todos os tempos. Fonte: Tiia MONTO, CC BY-SA 4.0, via Wikimedia Commons
Bebendo pássaro, um dos brinquedos mais engenhosos de todos os tempos. Fonte: Tiia MONTO, CC BY-SA 4.0, via Wikimedia Commons Embora não seja precisamente um equilíbrio de vapor líquido, a verdade é que, por trás da operação do pássaro que bebe, vários fenômenos termodinâmicos estão escondidos.
Quando a cabeça do pássaro está molhada, começa a esfriar quando a água evapora. Essa diminuição da temperatura causa uma diminuição na pressão dentro da cabeça do pássaro. O cloreto de metileno, localizado na base do pássaro, procurará equilibrar as pressões, fluindo através de um tubo de vidro que conecta a cabeça com a cabeça.
O líquido subirá para a cabeça do pássaro, tornando -o mais pesado e inclinando seu corpo para a frente. O pássaro então "bebe água" e pressões de vapor vão equilibrar. Equilibre as pressões, o pássaro do pássaro retornará à posição vertical e o ciclo será repetido enquanto a água da cabeça evapora novamente.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Walter J. Moore. (1962). Química Física. (Quarta edição). Longmans.
- Wikipedia. (2020). Equilíbrio de vapor-líquido. Recuperado de: em.Wikipedia.org
- Ed Vitz et al. (5 de novembro de 2020). Equilíbrio de vapor-líquido. Química Librettexts. Recuperado de: química.Librettexts.org
- Limer Eric. (30 de janeiro de 2018). Uma explicação absurdamente detalhada do brinquedo de pássaro que bebe. Recuperado de: PopularMechanics.com
- Universidade de Alicante. (s.F.). Tópico 4: Cálculo do Vapor de Balance. Diagramas de equilíbrio. [PDF]. Recuperado de: Rua.Ua.é

