Estrutura enolase, mecanismo de ação, funções
- 3628
- 219
- Shawn Leffler
O Enolase É a enzima encarregada de realizar a conversão de D-2-fosfoglicerado (2pga) em fosfoenolpiruvato (PEP) na glicólise e reação reversa na gliconeogênese, duas rotas metabólicas que fazem parte do metabolismo da energia celular.
A decisão de catalisar essa reação em uma ou outra direção depende do acesso que a célula à glicose tem. Isto é, das necessidades de adaptar seu metabolismo à degradação ou síntese para obter energia. Indispensável para a realização de seus processos vitais.
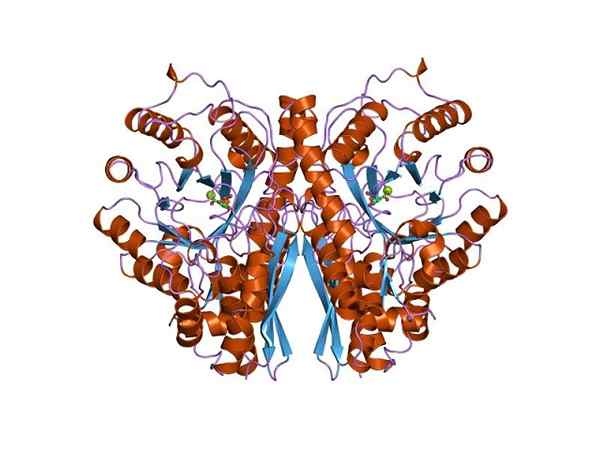
 Estrutura tridimensional de Enolasa. Por Jawahar Swaminathan e funcionários do MSD do Instituto Europeu de Bioinformática [Domínio Público (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons.
Estrutura tridimensional de Enolasa. Por Jawahar Swaminathan e funcionários do MSD do Instituto Europeu de Bioinformática [Domínio Público (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons. Como ambas as rotas metabólicas pertencem ao centro da árvore metabólica central dos seres vivos, não é estranho que a sequência de aminoácidos desta proteína seja preservada em Archeae, bactérias e eucariotos. E, portanto, isso apresenta propriedades catalíticas semelhantes.
A localização da enolase na célula é limitada ao citosol, um compartimento no qual a glicólise (também chamada glicólise) e a gluconeogênese na maioria dos organismos ocorrem.
No entanto, também foi detectado em outros compartimentos celulares, como a membrana plasmática de muitas células e células cancerígenas. Lá, parece estar envolvido com a facilitação de processos de disseminação de células, uma função totalmente diferente de sua função clássica.
As enzimas capazes de desempenhar mais de uma função, como a enolase, são conhecidas como enzimas de luar.
[TOC]
Estrutura
A estrutura quaternária do Linus ou não em seus ligantes foi determinada em um grande número de indivíduos procarióticos e eucarióticos.
Cada monômero apresenta dois domínios: um pequeno domínio amino-terminal e um domínio maior do terminal carboxil. O domínio N-terminal é composto por três α e quatro folhas β. Enquanto, o terminal C consiste em oito folhas β que alternam entre elas formando um barril β cercado por oito hélices α.
Além disso, dois locais da União para cátions divalentes são encontrados em cada monômero que foram chamados de "local conformacional" e "local catalítico". O primeiro não é muito seletivo e pode se juntar a uma ampla variedade de cátions divalentes na ausência de substrato.
Pode servir a você: esfingolipids: o que são, características, funções, sínteseEnquanto, o segundo se liga aos íons após o substrato se juntar à enzima. A união de íons para ambos os sites é vital para a reação prosseguir.
Finalmente, é importante mencionar que nos homodímeros, os monômeros se juntam a manter uma orientação paralela. Portanto, o local ativo é limitado à região central formada pelo referido sindicato.
No entanto, apenas um dos dois monômeros participa de catálise. Isso explica que a capacidade dos monômeros de realizar a reação em condições experimentais.
Mecanismo de ação
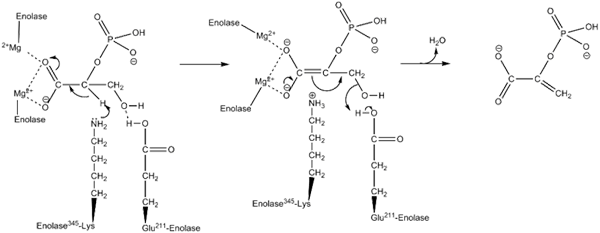 Mecanismo de ação usado pela enzima inolase. Por Kthompson08 na Wikipedia inglesa [Domínio Público (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons.
Mecanismo de ação usado pela enzima inolase. Por Kthompson08 na Wikipedia inglesa [Domínio Público (https: // CreativeCommons.Org/licenças/BY-SA/4.0)], da Wikimedia Commons. Estudos estruturais, bem como aqueles que permitiram determinar as características cinéticas e físico -químicas da Enolasa, nos permitiram entender seu mecanismo de ação.
A maneira pela qual a enzima realiza a catálise da reação é bastante interessante. Embora um único substrato esteja envolvido, um mecanismo seqüencial ordenado é o que foi proposto.
Isso começa com a união de um íon de mg2+ para o local conformacional de um dos monômeros. Contínuo com a união do substrato para o local ativo, seguido pela união de um segundo íon no local catalítico e conclui com a rápida liberação do produto depois que a reação for realizada. Neste ponto, o MG2+ permanece ligado ao site conformacional.
Na mesma linha, para favorecer a realização da reação, a enzima média, na primeira instância, a geração de um intermediário carbanion, eliminando um próton de carbono 2 do 2pga. Isso faz isso graças à ação de um resíduo básico de aminoácidos.
Sequencialmente, a remoção de hidroxila carbono 3 ocorre pela ação de um resíduo ácido da enzima. Neste ponto, a união de ambos os carbonos é realizada por meio de uma vínculo dupla formando pep. Dessa maneira, a reação é culminada.
Pode servir a você: Monera Kingdom: Características, Classificação e ExemplosFunções
Muitas das enzimas até agora estudadas são capazes de executar uma ampla variedade de funções não relacionadas à sua "função clássica" em diferentes compartimentos celulares. Essas enzimas foram chamadas de enzimas "luar".
Nesse sentido, a enolase pode ser considerada como uma luar enzimática, uma vez que inúmeras funções opostas à sua função clássica foram atribuídas até hoje em bactérias e eucariotos.
Algumas dessas funções são as seguintes:
- Participe da manutenção da forma celular e do tráfego vesicular ao interagir com as proteínas do citoesqueleto.
- No núcleo das células de mamíferos, atua como um fator de transcrição que regula a expressão de genes associados à proliferação celular. Cooperar na manutenção da estabilidade do RNM na degradação em bactérias.
- Em patógenos, como Streptococcus pneumoniae e Trypanosoma Cruzi, Parece que ele atua como um importante fator de virulência.
- Também foi descoberto que em Streptococcus pyogenes, A enolase é excretada para o meio extracelular facilitador de degradação tecidual e a evasão do sistema hospedeiro.
- Na superfície das células tumorais, é expressa aumentando a metástase.
Enolase e sua relação com mecanismos de disseminação celular
Numerosos patógenos, assim como as células tumorais, expressam em sua membrana ou excretam as proteases médias extracelulares capazes de degradar proteínas proteínas.
Essa capacidade permite que essas células rompem os tecidos e se espalhem rapidamente por todo o organismo anfitrião. Favorecendo assim a evasão do sistema imunológico e, portanto, o estabelecimento da infecção.
Mesmo quando a Enolasa não possui atividade de protease, participa do processo de disseminação de muitos patógenos em seu hospedeiro, bem como células tumorais durante as golsisias.
Isso o alcança graças ao fato de ser expresso na superfície dessas células funcionando como um receptor de plasminogênio. Este último é o zimogênio de uma prototease serina conhecida como plasminado que faz parte do sistema fibrinolítico e age proteínas de matriz extracelular degradantes.
Portanto, a enolase expressa na superfície é uma estratégia que essas células adquiriram para estabelecer a infecção e se espalhar com sucesso.
Pode servir a você: Especiação simpática: conceito, características e exemplosEsta estratégia consiste em dois processos:
- A evasão do sistema imunológico do hospedeiro. Como, quando essas células de uma proteína hospedeira são revestidas, elas são ignoradas por células do sistema imunológico que reconhecem patógenos não -proprietários associados a patógenos.
- Disseminação pós-ação do plasminogênio no plasminado. Cuja participação na degradação das proteínas da matriz extracelular e depois facilita a disseminação rápida e eficaz.
Referências
- Avilan L, Gualdron-Lopez M, Quiñones W, González-González L, Hannaert V, Michels PAA, Concepción JL. Enolase: um jogador-chave no metabolismo e um provável fator de virulência de parasitas-tripanossomatídeos-possíveis para seu uso como alvo terapêutico. Pesquisa enzimática. 2011 vol. Artigo ID932549, 14 páginas.
- Bhowmick I, Kumar N, Sharma S, Coppens I, Jarori GK, Plasmodium falciparum Enosoase: expressão específica de estágio e localização subcelular. Malaria Journal. 2009; 8 (1). Artigo 179.
- Dia I, Peshavaria M, Quinn GB, um relógio molecular diferencial na evolução da isoproteína de Enoase. Journal of Molecular Evolution. 1993; 36 (6): 599-601.
- do Torre-Scuder E, Manzano-Román R, Pérez-Sánchez R, Siles-Lucas M, Oleaga A. Clonagem e caracterização da enolae de ligação ao plasminogênio em ligação à superfície de Schistosoma bovis. Parasitologia veterinária. 2010; 173: 73-84.
- Dinovo EC, Boyer PD. Sondas isotópicas do mecanismo de reação da enolase. Taxas de câmbio inicial e equiquibium isótopo: efeitos de isótopos primários e secundários. J Biol Chem. 1971; 246 (14): 4586-4593.
- Kaberdin VR, Lin-Chao S, revelando novos papéis para componentes menores do e. RNA coli degradado. Biologia de RNA. 2009; 6 (4): 402-405.
- Keller A, Peltzer J, Carpentier G. Interações de Enolas. Biochimica et biophysica Acta. 2007; 1770 (6): 919-926.
- Lung J, Liu KJ, Chang JY, Leu SJ, Shih NY. O MBP-1 é codificado eficazmente por uma transcrição alternativa do gene enri1 butranslacionalmente regulado pela mudança de proteína dependente de proteassoma. FEBS Journal. 2010; 277 (20): 4308-4321.
- Pancholi v. Α-enolase multifuncional: seu papel nas doenças. Ciências da vida celular e molecular. 2001; 58 (7): 902-920.
- Poyner RR, Cleland WW, Reed GH. Papel de metal ins na catálise por enolase. Um mecanismo cinético ordenado para uma única enzima de substrato. Bioquímica. 2001; 40: 9008-8017.
- Segovia-Gamboa NC, Chávez-Munguía B, Medina-Flores A, Entamoeba invasores, Processo de Encistação e Enolase. Parasitologia experimental. 2010; 125 (2): 63-69.
- Tanaka M, Sugisaki K, Nakashima K, alternando níveis de mRNAs traduzíveis para isozimas enoase durante o desenvolvimento do músculo esquelético de Chickn. Comunicações de pesquisa bioquímicos e biofísicos. 1985; 133 (3): 868-872.

