Link pi
- 677
- 29
- Ralph Kohler
Explicamos o que é o link do PI, como suas características são formadas e damos vários exemplos
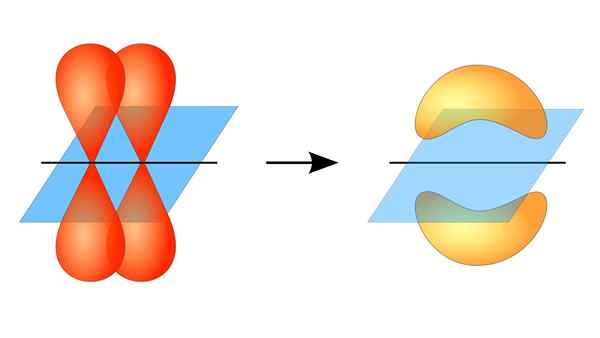
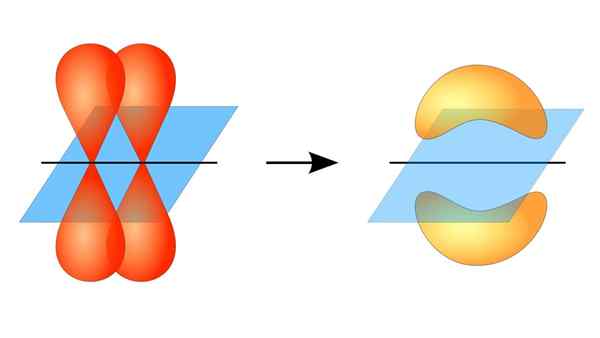 Dois orbitais p formando um link π
Dois orbitais p formando um link π O que é um link PI?
A Link pi (π) É um tipo covalente de link caracterizado por impedir o movimento de rotação livre de átomos e originar entre um par de orbitais atômicos puros, entre outras peculiaridades. Existem links que podem ser formados entre átomos por seus elétrons, que lhes permitem construir estruturas maiores e mais complexas: moléculas.
Esses links podem ser de variedades diferentes, mas as mais comuns neste campo de estudo são a covalente. As ligações covalentes, também chamadas de molecular, são um tipo de link em que os átomos envolvidos compartilham pares de elétrons.
Isso pode ocorrer devido à necessidade de átomos buscarem estabilidade, formando a maioria dos compostos que são conhecidos. Nesse sentido, as ligações covalentes podem ser simples, duplas ou triplas, dependendo da configuração de seus orbitais e da quantidade de pares de elétrons compartilhados entre os átomos envolvidos.
É por isso que existem dois tipos de ligação covalente que são formadas entre átomos com base na orientação de seus orbitais: os links sigma (σ) e os links PI (π) (π).
É importante diferenciar os dois links, pois o link sigma é apresentado em sindicatos simples e o PI em múltiplos sindicatos entre átomos (dois ou mais elétrons são compartilhados).
Como são os formulários de link PI?
Para descrever a formação do link PI, ele deve primeiro ser discutido sobre o processo de hibridação, pois intervém em alguns links importantes.
A hibridação é um processo em que os orbitais eletrônicos híbridos são formados; isto é, onde os orbitais atômicos de nível s e p podem ser misturados. Isso causa a formação de orbitais SP, SP2 e sp3, que são chamados híbridos.
Pode servir a você: reação reversível: características e exemplosNesse sentido, a formação dos links de PI ocorre graças à sobreposição de alguns lobos pertencentes a um orbital atômico em outro par de lobos que estão em um orbital que faz parte de outro átomo.
Essa sobreposição orbital ocorre lateralmente; portanto, a distribuição eletrônica é concentrada principalmente acima e abaixo do plano que forma os núcleos atômicos ligados e faz com que as ligações PI sejam mais fracas que as ligações sigma.
Ao falar sobre a simetria orbital desse tipo de união, deve -se mencionar que é igual ao dos orbitais P tipo P, desde que seja observado através do eixo formado pelo link. Além disso, esses sindicatos são constituídos principalmente por orbitais p.
Formação de ligação PI em diferentes espécies químicas
Como as ligações PI são sempre acompanhadas de um ou dois links (um sigma ou outro pi e um sigma), é relevante saber que a ligação dupla formada entre dois átomos de carbono (constituída por uma ligação sigma e uma) possui energia de ligação mais baixa do que a correspondente a duas vezes o link sigma entre os dois.
Isso é explicado pela estabilidade do link sigma, que é maior que o da ligação PI, porque a sobreposição de orbitais atômicos neste último ocorre em paralelo nas regiões acima e sob os lobos, acumulando distribuição eletrônica em um caminho atômico de maneira atômica núcleos.
Apesar disso, quando os links de Pi e Sigma são combinados um link múltiplo mais alto que o link simples por si só, que pode ser verificado observando os comprimentos do link entre vários átomos com links simples e múltiplos.
Pode atendê -lo: óxidos não -metálicosExistem algumas espécies químicas estudadas por seu comportamento excepcional, como compostos de coordenação com elementos metálicos, nos quais os átomos centrais são unidos apenas por ligações PI.
Características do link PI
Não permite o movimento de rotação livre de átomos
As características que distinguem os links de PI de outros tipos de interações entre espécies atômicas são descritas abaixo, começando com o fato de que essa união não permite o movimento de rotação livre de átomos, como o carbono. Por esse motivo, se houver uma rotação dos átomos, a ruptura da ligação ocorre.
Sobreposição entre orbitais por duas regiões paralelas
Da mesma forma, nesses links, a sobreposição entre os orbitais acontece através de duas regiões paralelas, fazendo com que elas tenham uma difusão maior do que as ligações sigma e que, por esse motivo, são mais fracas.
Entre alguns orbitais atômicos puros
Por outro lado, como mencionado acima, o link PI é sempre gerado entre um par de orbitais atômicos puros; Isso significa que os meios são gerados entre os orbitais que não sofreram processos de hibridação, nos quais a densidade dos elétrons está concentrada acima e abaixo do plano formado pela união covalente.
Nesse sentido, mais de um link PI pode ser apresentado entre alguns átomos, sempre sendo acompanhado por um link sigma (em ligações duplas).

Da mesma forma, você pode fornecer um vínculo triplo entre dois átomos adjacentes, que são formados por duas ligações PI em posições que formam planos perpendiculares entre si e um link sigma entre os dois átomos.
Pode atendê -lo: ácido húmico: estrutura, propriedades, obtenção, usoExemplos de links PI
Molécula de etileno
Como afirmado anteriormente, as moléculas constituídas por átomos unidos por uma ou mais ligações PI sempre têm vários links; isto é, duplo ou triplo.
Um exemplo disso é a molécula de etileno (h2C = ch2), que é constituído por uma união dupla; Ou seja, um Pi e uma ligação sigma entre seus átomos de carbono, além das ligações sigma entre carbonos e hidrogênios.
Molécula de acetileno
Por sua parte, a molécula de acetileno (H-Crames-H) possui uma ligação tripla entre seus átomos de carbono; Ou seja, duas ligações PI formando planos perpendiculares e uma ligação sigma, além de suas ligações correspondentes de carbono-hidrogênio.
Benzeno e derivados
Também são apresentadas ligações PI entre moléculas cíclicas6H6) e seus derivados, cuja disposição resulta em um efeito chamado ressonância, que permite que a densidade eletrônica migre entre átomos e concessão, entre outras coisas, maior estabilidade para o composto.
Dicarbon
Para exemplificar as exceções mencionadas anteriormente, os casos da molécula dicarbonal (C = C, nos quais ambos os átomos têm um par de elétrons emparelhados) e o composto de coordenação chamado hexacarbonildihierro (representado como fé2(CO)6, que é formado apenas por links PI entre seus átomos).

