Ligação covalente coordenada
- 4277
- 434
- Melvin Mueller
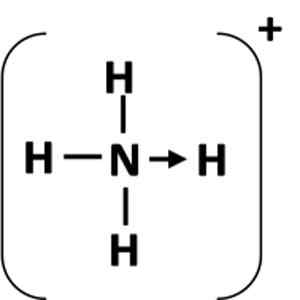
 Figura 1: Representação de um vínculo de coordenação entre o átomo do doador (n) e o aceitador (h).
Figura 1: Representação de um vínculo de coordenação entre o átomo do doador (n) e o aceitador (h). O que é um link covalente coordenado?
A ligação covalente coordenada, ou link de coordenação, éUm tipo de link no qual um dos átomos fornece todos os elétrons compartilhados. Também é chamado de link dativo ou bipolar.
Em um link covalente simples, cada átomo fornece um elétron ao link. Por outro lado, em um link de coordenação, um único átomo doa os elétrons para formar o link e é chamado de átomo do doador, enquanto o átomo que aceita o par de elétrons para se juntar é chamado de átomo aceitador.
Um link de coordenação é representado por uma seta que começa a partir dos átomos de doação e termina no átomo aceitador (Figura 1). Em alguns casos, o doador pode ser uma molécula.
Nesse caso, um átomo na molécula pode doar o par de elétrons, que seria a base de Lewis, enquanto a molécula com a capacidade aceitadora seria o ácido Lewis ácido.
Um link de coordenação tem características semelhantes às de uma ligação covalente simples. Os compostos que têm esse tipo de link geralmente têm um ponto de fusão e ebulição baixo, com uma interação coulômbica não existente entre átomos (diferentemente da ligação iônica) e os compostos são muito solúveis em água.
Alguns exemplos de links covalentes coordenados
O exemplo mais comum de um vínculo de coordenação é o íon de amônio, que é formado pela combinação de uma molécula de amônia e um próton de um ácido.
Pode atendê -lo: equação química: peças e exemplosNa amônia, o átomo de nitrogênio tem um par solitário de elétrons após a conclusão do octeto. Feito esse par solitário ao íon hidrogênio, assim o átomo de nitrogênio se torna um doador. O átomo de hidrogênio se torna o aceitador.
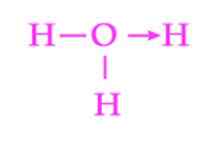 Figura 2: Representação do link de coordenação do hidronio
Figura 2: Representação do link de coordenação do hidronio Outro exemplo comum de link dativo é a formação do íon hidrônio. Assim como no íon de amônio, o par de elétrons livres da molécula de água serve como um doador para o próton que é o aceitador (Figura 2).
No entanto, deve -se ter em mente que, uma vez estabelecido o vínculo de coordenação, todos os hidrogênios anexados ao oxigênio são exatamente equivalentes. Quando um íon hidrogênio quebra novamente, não há discriminação entre quais dos hidrogênios são liberados.
Um excelente exemplo de uma reação ácida baseada em ácido, que ilustra a formação de uma ligação covalente coordenada é a reação de formação do aducto de Trifluoreto de Boron com amônia.
O trifluoreto de boro é um composto que não possui uma estrutura de gás nobre ao redor do Boro Atom. O boro possui apenas 3 pares de elétrons em sua camada de valência, por isso se diz que o BF3 é deficiente em elétrons.
O torque de nitrogênio de nitrogênio da amônia pode ser usado para superar essa deficiência, e é formado um composto que implica um link de coordenação.
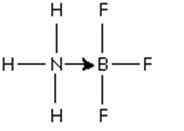 Figura 3: Aduto entre a molécula de trifluoreto de boro e a amônia
Figura 3: Aduto entre a molécula de trifluoreto de boro e a amônia Esse par de elétrons de nitrogênio é doado ao orbital P vazio de boro. Aqui a amônia é a base de Lewis e BF3 é o ácido de Lewis.
Pode atendê -lo: valências de nitrogênioQuímica de coordenação
Há um ramo da química inorgânica dedicada exclusivamente ao estudo de compostos que formam metais de transição. Esses metais se ligam a outros átomos ou moléculas através de links de coordenação para formar moléculas complexas.
Essas moléculas são conhecidas como compostos de coordenação e a ciência que os estuda é chamada de química de coordenação.
Nesse caso, a substância ligada ao metal, que seria o doador de elétrons, é conhecida como ligando e comumente aos compostos de coordenação são conhecidos como complexos.
Os compostos de coordenação incluem substâncias como vitamina B12, hemoglobina e clorofila, corantes e pigmentos e catalisadores usados na preparação de substâncias orgânicas.
Um exemplo de um íon complexo seria o complexo cobalto [CO (NH2CH2CH2NH2) 2clnh3]2+ Esse seria o Dicloroaminethylandiamin cobalto (IV).
A química da coordenação surgiu do trabalho de Alfred Werner, um químico suíço que examinou vários compostos de cloreto de cobalto (III) e amoníaco. Após a adição de ácido clorídrico, Werner observou que a amônia não poderia ser completamente eliminada. Ele então propôs que a amônia estivesse mais intimamente ligada ao íon cobalto central.
No entanto, quando o nitrato de prata aquoso foi adicionado, um dos produtos formados era um cloreto de prata sólido. A quantidade de cloreto de prata formada estava relacionada ao número de moléculas de amônia ligadas ao cloreto de cobalto (III).
Por exemplo, quando o nitrato de prata foi adicionado ao cocl3 · 6NH3, Os três cloretos se tornaram cloreto de prata.
No entanto, quando o nitrato de prata foi adicionado ao cocl3 · 5NH3, Apenas 2 dos 3 cloretos formavam cloreto de prata. Quando era cocl3.4NH3 Com nitrato de prata, um dos três cloretos precipitados como cloreto de prata.
Pode atendê -lo: ácido pícrico: o que é, estrutura, síntese, propriedadesAs observações resultantes sugeriram a formação de compostos complexos ou coordenação. Na esfera de coordenação interna, que também é referida em alguns textos como a primeira esfera, os ligantes estão diretamente unidos ao metal central.
Na esfera de coordenação externa, às vezes chamada de segunda esfera, outros íons são anexados ao íon complexo. Werner recebeu o Prêmio Nobel em 1913 por sua teoria da coordenação.
Essa teoria da coordenação faz com que os metais de transição tenham dois tipos de Valência: a primeira Valencia, determinada pelo número de oxidação do metal, e o outro Valencia chamado Número de Coordenação.
O número de oxidação diz quantas ligações covalentes podem ser formadas em metal (exemplo, ferro (ii) produz feio) e o número de coordenação diz quantos links de coordenação podem ser formados no complexo (exemplo, ferro com coordenação número 44]- e [FECL4]2-).
No caso de cobalto, possui coordenação número 6. É por isso que nos experimentos de Werner, adicionando o nitrato de prata, a quantidade de cloreto de prata que deixou um cobalto hexacoordinado sempre foi obtido.
Os links de coordenação desse tipo de composto têm a característica de ser colorida.
De fato, eles são responsáveis pela coloração típica associada a um metal (ferro vermelho, cobalto azul, etc.) e são importantes para ensaios espectrofotométricos de absorção e emissão atômica.
Referências
- Ligação química. Recuperado da Britannica.com.
- Coordenar a ligação covalente (S.F.). Recuperado da química.Tutorvista.

