Enantiômeros
- 4897
- 460
- Mr. Reginald Lindgren
Explicamos o que enantiômeros e quiralidade, suas propriedades, nomenclatura e vários exemplos são
 Esses dois compostos são enantiômeros, pois são formados pelos mesmos átomos, unidos da mesma maneira e são imagens especulares uma da outra
Esses dois compostos são enantiômeros, pois são formados pelos mesmos átomos, unidos da mesma maneira e são imagens especulares uma da outra Quais são os enantiômeros?
O enantiômeros São pares de compostos que são imagens espelhadas não sobreplumáveis uma da outra. Esses pares de compostos são um tipo particular de isômeros, ou seja, são compostos diferentes que têm a mesma fórmula molecular.
Existem diferentes tipos de isômeros entre os quais estereoisômeros, nos quais todos os átomos estão unidos na mesma ordem e com o mesmo tipo de links, mas eles têm orientações diferentes no espaço (estéreo significa espaço).
Dentro dos estereoisômeros, encontramos os enantiômeros, cuja característica principal é ser imagens especulares entre si.
Enantiômeros são muito comuns de natureza. De fato, quase todos os compostos orgânicos presentes nas células de todos os seres vivos são um dos dois enantiômeros possíveis.
Por exemplo, todos os aminoácidos que fazem parte das proteínas naturais correspondem ao enantiômero L do respectivo aminoácido (o outro isômero se identifica com a letra D).
Por outro lado, os ingredientes ativos da grande maioria dos medicamentos também existem como pares de enantiômeros, dos quais apenas um é eficaz. A dificuldade em separar enantiômeros um do outro significa que os medicamentos que contêm apenas o isômero úteis são muito caros.
Enantiômeros e quiralidade
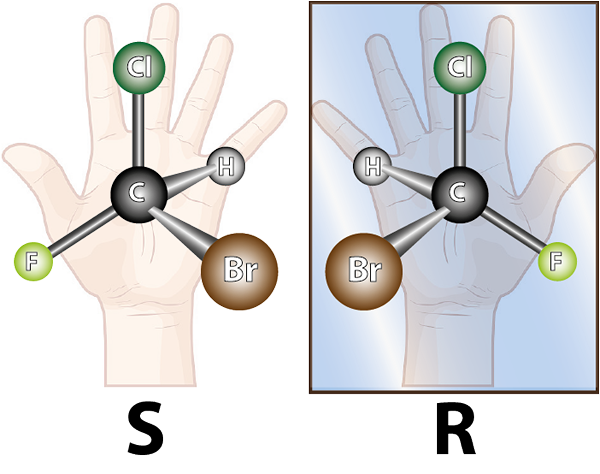
Enantiômeros são formados por moléculas quirais. A quiralidade é de propriedade de não ser superada com sua imagem espelhada. A palavra quiral vem do termo grego, Kheir o que significa mão, lembrando o fato de que as mãos também são imagens especulares uma da outra, e elas não podem se sobrepor.
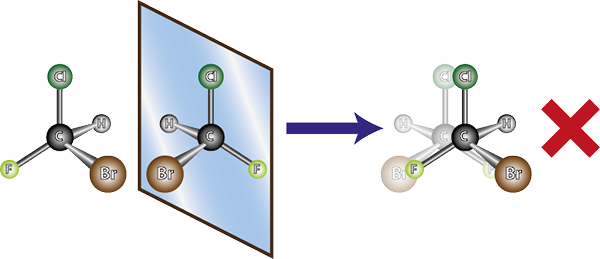 A molécula da esquerda é quiral, pois ao compará -la com sua imagem espelhada, pode -se ver que eles não estão se sobrepõem. Em outras palavras, não há como girá -lo ou transformá -lo de tal maneira que todos os átomos coincidam um com o outro
A molécula da esquerda é quiral, pois ao compará -la com sua imagem espelhada, pode -se ver que eles não estão se sobrepõem. Em outras palavras, não há como girá -lo ou transformá -lo de tal maneira que todos os átomos coincidam um com o outro Em vista do exposto, pode -se deduzir que, para cada molécula quiral, deve haver outra molécula quiral que não seja a imagem espelhada sobreposta, ou seja, seu enantiômero. Em outras palavras, sempre que uma molécula é dita.
Pode atendê -lo: neodímio: estrutura, propriedades, usosCentros quirais
Muitos compostos quirais têm um ou mais centros assimétricos responsáveis pela quiralidade da molécula. Estes são chamados centros quirais e em muitos compostos orgânicos consistem em átomos de carbono que estão ligados a 4 átomos ou grupos de diferentes átomos.
A forma particular, pois esses quatro grupos são distribuídos em torno de carbono assimétrico determina qual dos dois enantiômeros corresponde a uma molécula quiral. A presença de um único centro quiral garante que a molécula seja quiral, mas se houver mais de um, pode ser quiral como pode não.
Propriedades do ENONTIOMER
A maioria das propriedades físicas e químicas são idênticas
Como a mão direita e a mão esquerda, os enantiômeros só vêm em pares. Esses compostos são praticamente idênticos entre si. De fato, a maioria de suas propriedades físicas e químicas, como o ponto de fusão, ebulição, pressão do vapor e solubilidade em alguns solventes, entre outros, são idênticos.
Atividade óptica
Todos os compostos quirais têm uma propriedade única que os distingue daqueles que não são: eles têm a capacidade de girar o plano da luz polarizada. Esta propriedade é chamada Atividade óptica, E é uma das poucas propriedades que distingue um composto quiral de seu enantiômero.
Este último se deve ao fato de que o plano de luz polarizado pode ser girado em uma das duas direções, na direção das agulhas do relógio (chamado dextrogyr e representado com o símbolo +) ou contra as agulhas do relógio (levóguiro, representadas com o símbolo -).
Se um composto quiral girar o plano de luz polarizado em uma direção, seu enantiômero o transformará na direção oposta.
-
Exemplo
Uma solução d-glucosa gira o plano de luz polarizado na direção das agulhas do relógio (à direita, é dextrogyral), enquanto uma solução de L-glicose faz com que a gire na direção oposta.
Pode atendê -lo: Flask Erlenmeyer: características, usos, métodos de usoReatividade diferencial
Outra propriedade que permite distinguir um enantión do outro é sua reatividade contra outros compostos quirais.
A reatividade diferencial pode ser comparada à maneira como uma luva parece boa em uma mão, mas não a outra, ou como um sapato direito se encaixa bem no pé direito, mas não para a esquerda.
Uma conseqüência importante da reatividade diferencial são os diferentes efeitos que podem causar os dois enantiômeros de alguns medicamentos. Essas diferenças podem ser inofensivas, mas também podem ser muito perigosas.
-
Exemplos
- Dos dois enantimers do aspartame (que é um adoçante artificial), um é doce enquanto o outro não tem sabor.
- Somente os enantiômeros do omeprazol são eficazes como um protetor gástrico, enquanto o outro não produz nenhum efeito.
- D-penicilamina é um medicamento contra a artrite reumatóide, enquanto seu enantiômero, L-penicilamina é um veneno perigoso.
Absorção diferencial
Os enantiômeros também diferem na maneira como são absorvidos em resinas ou sólidos que também são quirais. Uma mistura de enantiômeros pode ser separada se for passado através de uma coluna de separação quiral, uma vez que um dos dois enantiômeros será absorvido mais fortemente do que o outro.
Nomenclatura de enantiômeros
Existem vários métodos para identificar um ou outro enantiômer, mas o mais usado é o sistema Cahn-Ingold-PréLog (CIP). Isso consiste nas seguintes etapas:
- Um nível de hierarquia é atribuído aos quatro grupos anexados a cada centro quiral. A prioridade dos grupos é atribuída de acordo com o número atômico do átomo diretamente ligado ao centro quiral. Se houver dois átomos iguais, os números atômicos dos átomos que estão ligados à primeira são adicionados para adicionar os números atômicos.
- A direção em que os três grupos prioritários são percorridos quando os pontos de prioridade mais baixos são determinados.
- Se a direção da rota estiver na direção das mãos do relógio, a configuração será atribuída R, caso contrário, a configuração será atribuída S.
Exemplo
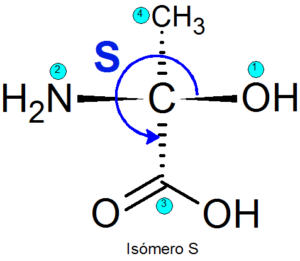
Exemplos de enantiômeros
D-gliceraldeído e L-gliceraldeído
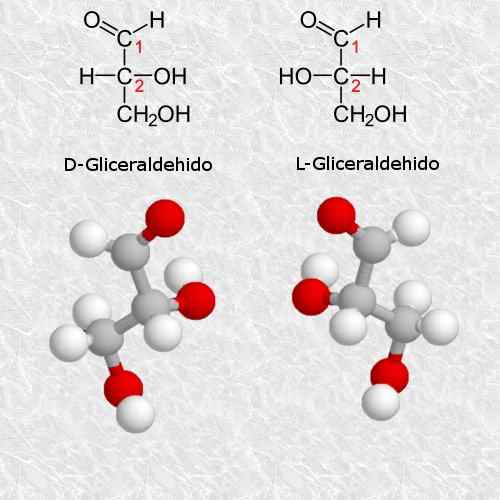
O gliceraldeído é o mais simples e pequeno carboidrato quiral que existe e é muito importante para química e biologia.
De acordo com as regras do sistema Cahn-ingold-PréLog, o isômero D corresponde ao isômero (R) e o isômero L corresponde a (s) (s) (s) (s) (s) (s) (s) (s) (s) (s) (s) (s) (s).
D-Alanina e L-Alanina
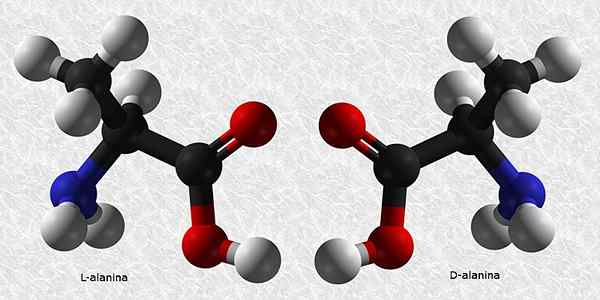
Alanina é um dos aminoácidos essenciais para a construção de proteínas. Como quase todos os aminoácidos, ele tem um carbono quiral, por isso tem dois enantiômeros:
Desses dois, L-Alanina é o mais comum e está presente em todos os seres vivos, enquanto a D-Alanina está presente apenas em algumas paredes celulares bacterianas.
Ácido d-tartarico e L-tartarico
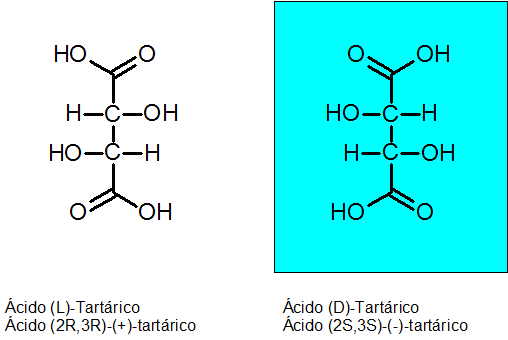
A quiralidade foi descoberta por Louis Pasteur em 1848 graças ao ácido tartárico. Este composto possui 2 carbonos assimétricos e pode existir como dois enantiômeros, além de um terceiro isômero chamado Meso composto.
A configuração absoluta dos dois carbonos quirais é r para o enantiómero levóguiro e s para o dextrogyan enantiom.
2-butanol
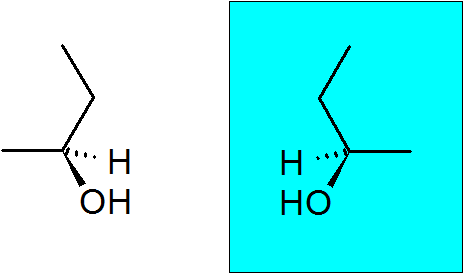
Este álcool também tem um carbono quiral, o que faz com que este composto tenha dois enantiômeros.
Bromocloroetano
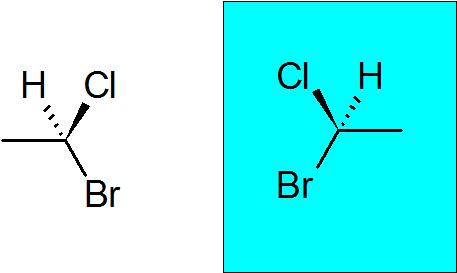
É um composto quiral muito simples com apenas dois carbonos. O carbono quiral se juntou a um bromo, um cloro, um metil e um hidrogênio.
Referências
- Quiralidade (química). (18 de março de 2021), na Wikipedia.com
- Carey, f. PARA. (2008). Química orgânica. Boston: McGraw-Hill Ensino Superior.
- Smith, m., Março, j., E março, J. (2001). Química orgânica avançada de março: reações, mecanismos e estratégia. Nova York: Wiley.
- M.H. Hyun (2012). 8.13 Separações e análises cromatográficas: fases estacionárias quirais da coroa quiral da coroa. Editor (s): Erick M. Carreira, Hisahi Yamamoto. Entendendo a quiralidade. Elsevier. Páginas 263-285. ISBN 9780080951683,
- Nguyen, l. PARA., Ele, h., & Pham-huy, c. (2006). Drogas quirais: uma visão geral. Jornal Internacional de Ciência Biomédica: IJBS, 2(2), 85-100.

