Elementos, compostos e misturas
- 3832
- 1158
- Ernesto Bruen
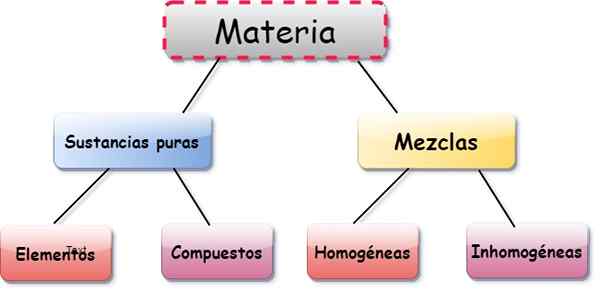
Elementos, compostos e misturas são três formas de apresentação da matéria. O Unid São substâncias constituídas por uma única classe de átomo, o compostos São combinações entre dois ou mais elementos, e misturas Eles resultam da composição de vários elementos e substâncias.
Os componentes das misturas são separados por meios físicos. Por sua parte, para separar os elementos de um composto, os procedimentos químicos devem ser realizados.
Não há como separá -los em componentes menores com métodos comuns, mas existem maneiras de fissurar átomos. De fato, a fissão é uma maneira de extrair energia deles.
Os átomos que compõem um determinado composto sempre o fazem em proporções fixas. Por sua vez, em uma mistura as proporções de seus componentes podem variar. Portanto, os elementos e compostos são considerados substâncias puras, cuja composição é constante e bem definida.
Por exemplo, o sal de mesa ou cloreto de sódio é um composto no qual os átomos de cloro e sódio participam, em uma proporção de um por um. Enquanto isso, o leite é uma mistura de composição variável, na qual cada componente mantém sua identidade.
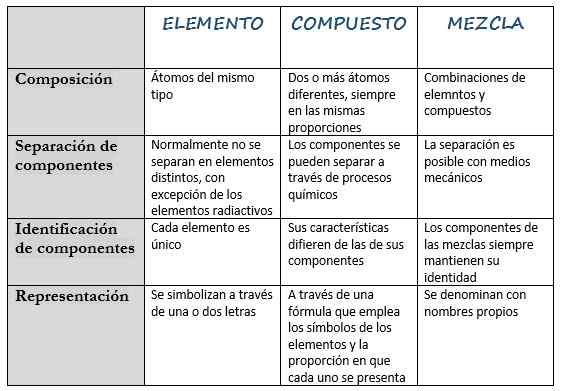
A tabela a seguir reúne suas principais características:
Elemento | Composto | Misturar | |
Definição | Substância que não pode ser decomposta em outras substâncias mais simples. | Substância constituída por dois ou mais elementos diferentes. | Substância feita ao misturar outras substâncias. |
Composição | Átomos do mesmo tipo. | Dois ou mais átomos diferentes, sempre nas mesmas proporções. | Combinações de elementos e compostos. |
Separação de componentes | Normalmente eles não se separam em elementos diferentes, com exceção dos elementos radioativos. | Os componentes podem ser separados através de processos químicos. | A separação é possível com meios mecânicos. |
Identificação de componentes | Cada elemento é único. | Suas características diferem das de seus componentes. | Os componentes das misturas sempre mantêm sua identidade. |
Representação | Eles são simbolizados em uma ou duas letras. | Através de uma fórmula que usa os símbolos dos elementos e a proporção em que cada um é apresentado. | É chamado com nomes próprios. |
Exemplos | Hidrogênio (h), silício (sim), hélio (He), ouro (AU), potássio (k). | Cloreto de sódio (NaCl), amônia (NH3), hidreto de sódio (Nah), dióxido de nitrogênio (NO2). | Sangue, leite, ar, cimento. |
Unid
Definição
Os elementos são substâncias puras e simples, em cuja composição apenas átomos do mesmo tipo intervêm. O comportamento químico de cada elemento é característico e não há dois iguais, embora existam características comuns entre grupos de elementos.
Pode atendê -lo: iodometria: fundações, reações, procedimento geral, usosNão é possível decompor um elemento em um mais simples, exceto por procedimentos especiais, como Bombard.
O processo de desintegração ocorre espontaneamente em algumas substâncias, como rádio, certas variedades de urânio, tório e outros elementos chamados radioativos.
Composição
Os elementos são formados por átomos idênticos. Estes, por sua vez, são compostos de três tipos de partículas: elétrons, prótons e nêutrons. Elétrons e prótons têm massa elétrica, negativa e positiva, respectivamente. Os nêutrons têm massa, mas não carregam.
O átomo consiste em um núcleo atômico formado por prótons e nêutrons, enquanto os elétrons são distribuídos em orbitais ao seu redor. Um elemento é distinguido de outro pelo número de prótons que seu núcleo, chamado de número atômico.
Embora isso permaneça constante, é o mesmo elemento, mesmo que o número de nêutrons e elétrons mude, pois nesse caso o isótopos.
Identificação de componentes
Técnicas diferentes e complexas são usadas, por exemplo, para "ver" os elétrons do átomo, existem microscópios especiais, como o Microscópio de Efeito do Túnel.
Técnica de separação
O átomo de um elemento não é separado através de métodos químicos, mas é bombardeado com partículas menores, geralmente nêutrons, em um processo chamado fissão nuclear. Mas, embora, em teoria, todo átomo seja fisicamente, é mais fácil fazê-lo com átomos com núcleos pesados, como o urânio-235.
Tipos de elementos
Existem 118 elementos, localizados na tabela periódica, ordenados por número atômico. Destes, 92 são encontrados na natureza e os restantes são obtidos no laboratório.
Pode servir a você: carbono amorfo: o que é, tipos, propriedades, usosEles são distribuídos em três grupos:
- Metais, com elétrons livres que os tornam bons condutores de calor e eletricidade, quase sempre sólidos (exceto mercúrio) e alta densidade.
- Não há metais, falta propriedades de conduta, são apresentados em estado sólido ou gasoso, exceto o bromo, e sua densidade é menor.
- Metalóides, elementos com características intermediárias entre metais e não -metais.
Representação gráfica
Cada elemento da tabela periódica é simbolizado com letras. Por exemplo, H, O, C e Fe correspondem, respectivamente, a hidrogênio, oxigênio, carbono e ferro.
Exemplos de elementos
Além dos mencionados, existem os seguintes elementos, com seu símbolo entre parênteses:
- Cloro (CL)
- Mercúrio (HG)
- Fósforo (P)
- Iodo (i)
- Magnésio (mg)
Compostos
Definição
Os compostos são substâncias puras, cuja composição dois ou mais tipos de átomos diferentes estão envolvidos, em certas proporções, para formar moléculas. Os sindicatos entre os átomos são realizados por links, que são um fator determinante nas propriedades compostas.
Os principais links são:
- Iônico
- Metal
- Covalente
Composição
Os compostos consistem em dois ou mais tipos de átomos, sempre em proporção fixa.
Identificação de componentes
Cada composto possui propriedades que o tornam único, que diferem das de seus elementos constituintes, porque perdem sua identidade, formando o composto. Por exemplo, à temperatura ambiente, hidrogênio e oxigênio são gases, que, quando combinados, dão origem à água.
Técnica de separação
Normalmente, os compostos são separados por reações químicas, embora a radiação eletromagnética, incluindo luz, também seja capaz de dissociar moléculas.
Tipos de compostos
Os compostos são divididos em duas categorias principais:
- Inorgânico
- Orgânico
A diferença é que os compostos orgânicos são baseados no elemento de carbono, quando forma o tipo de covalente com hidrogênio. O carbono participa da mesma maneira em muitos compostos inorgânicos, formando outros links.
Representação gráfica
Isso é feito através de sua fórmula química, na qual seus constituintes são especificados, com seu respectivo símbolo e a proporção em que participam. Os compostos também têm vários nomes.
Exemplos de compostos
- Cloreto de sódio ou sal de mesa (NaCl)
- Bicarbonato de sódio (nahco₃)
- Amônia (NH3)
- Carbonato de cálcio (caco3)
- Glicose (c₆h₁₂o₆)
Misturas
Definição
Combinação de dois ou mais elementos e/ou compostos, sem proporções definidas, cada uma mantendo sua identidade, isto é, sem que suas propriedades mudem quando fazem parte da mistura.
Composição
É variável.
Identificação de componentes
É mais simples de realizar, porque os componentes mantêm sua identidade.
Técnica de separação
Os componentes de uma mistura podem ser separados por algum método físico ou mecânico, como filtragem ou centrifugação, por exemplo.
Tipos de misturas
As misturas são classificadas como:
- Homogêneo: as partículas de componentes são indistinguíveis, apesar de serem de diferentes substâncias. Por exemplo, açúcar muito dissolvido na água.
- Heterogêneo: misturas nas quais as partículas são distinguidas, mesmo a olho nu, como areia e sal, ou sal misturado com arquivos de metal.
Representação gráfica
As misturas não têm uma fórmula definida, mas muitos têm seus próprios nomes.
Exemplos de misturas
- Cimento
- Molho de tomate
- Madeira
- Ar
- Leite
- Concreto
- Sangue

