Características do eletrodo de referência, função, exemplos
- 975
- 289
- Terrence King IV
Ele eletrodo de referência É um dispositivo usado na análise potenciométrica e voltamétrica para a determinação quantitativa de um analito. Sua importância é, como o nome indica, servir de referência para estimar o verdadeiro valor do potencial na reação de um semi -elk eletroquímico.
Os potenciais de uma semi -media dependem da concentração de um íon de interesse, uma vez que reage ao ganhar ou perder elétrons. Dessa forma, é possível determinar sua concentração através desses potenciais. No entanto, seus valores não são absolutos, mas relacionados ao eletrodo de hidrogênio padrão (ela em inglês).
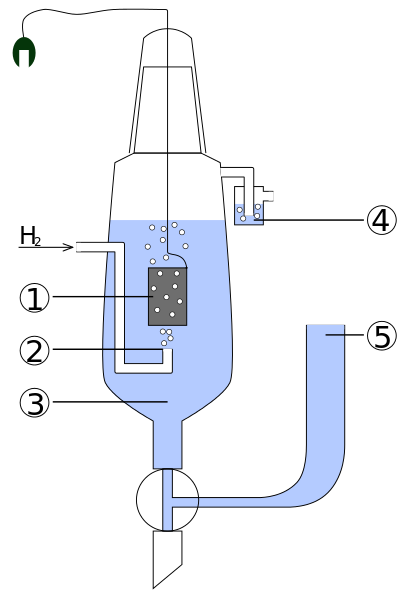
 Diagrama das partes de um hidrogênio padrão eletro. Fonte: Standard_Hydrogen_electrode.JPG: Trabalho KaverinderiveVative: Henry Muelpfordt/CC BY-S (http: // criativecommons.Org/licenças/BY-SA/3.0/)
Diagrama das partes de um hidrogênio padrão eletro. Fonte: Standard_Hydrogen_electrode.JPG: Trabalho KaverinderiveVative: Henry Muelpfordt/CC BY-S (http: // criativecommons.Org/licenças/BY-SA/3.0/) Por convenção, os potenciais de eletrodos de hidrogênio são iguais a 0V. O problema é que esses eletrodos são difíceis de manipular, por isso não são práticos para instalá -los em todas as análises. É aqui que os eletrodos de referência entram, muito mais simples, e cujo potencial são diferentes de 0V.
Alguns dos eletrodos de referência, como o eletrodo saturado de Calomel (ESC), podem ser construídos no mesmo laboratório antes que a análise seja realizada. Da mesma forma, eles são obtidos abertamente no mercado com suas especificações adequadas, e os riscos de contaminar a amostra do analito são mínimos.
[TOC]
Características do eletrodo de referência
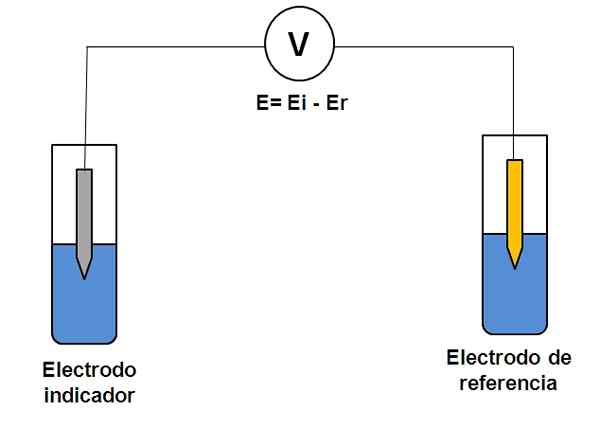 Representação simples de um sistema de dois eletrodos em potenciometria. Fonte: Gabriel Bolívar.
Representação simples de um sistema de dois eletrodos em potenciometria. Fonte: Gabriel Bolívar. Considere o sistema de dois eletrodos acima. Um é o indicador (cinza), onde a reação de interesse ocorre e o outro é a referência (ouro). Esta célula eletroquímica terá um potencial e, que será igual à diferença dos potenciais de ambos os eletrodos (ei-e). Portanto, qualquer variação em E deve ser devida ao potencial do eletrodo indicador.
Pode atendê -lo: cianeto de potássio (KCN): propriedades, usos, estruturas, riscos,Do exposto, conclui -se que o eletrodo de referência possui as seguintes características:
-Tem um potencial estável durante o tempo e é reproduzível. Isto é, deve ser o mesmo, independentemente de onde ou quantas vezes as medidas são feitas.
-Sua composição química é constante e insensível, por isso dificilmente sofre mudanças quando interage com a solução do analito ou mergulha em um meio aquoso.
-É fácil de construir e montar, diferentemente do eletrodo de hidrogênio padrão, que exige o uso de um tanque de hidrogênio e corre os riscos de explosão quando o hidrogênio se mistura com o ar com o ar.
O eletrodo indicador é sensível à concentração do analito.
Função de eletrodo de referência
Os potenciais de eletrodos de referência são medidos em relação ao eletrodo de hidrogênio padrão, portanto seus valores são diferentes de 0V. Graças a esses eletrodos de hidrogênio, a construção das tabelas padrão e padrão de potencial é possível, que aparecem nos textos de química para reações redox Symphines.
No entanto, na prática, não está carregando um eletrodo de hidrogênio em todos os lugares. Em vez disso, os eletrodos de referência são usados, muito mais simples e com segurança para manipular.
Como seus potenciais são constantes e estáveis, as leituras potenciais da célula eletroquímica são exclusivamente devido ao eletrodo indicador; isto é, para as variações de concentração do analito em questão.
Assim, a função de eletrodo de referência é determinar o potencial de qualquer reação em um dos semi -limites do sistema eletroquímico. Se seus potenciais não fossem estáveis, as determinações quantitativas do analito não seriam confiáveis. Qualquer análise potenciométrica ou voltamétrica deve especificar qual eletrodo de referência eles usavam para relatar seus resultados.
Pode servir a você: ácido bromo (hbro2): propriedades físicas e químicas e usosExemplos de eletrodos de referência
Existem vários eletrodos de referência disponíveis no mercado. Alguns usados para determinações muito específicas. No entanto, existem dois eletrodos entre todos eles que se destacam graças à sua simplicidade e praticidade: o eletrodo de calomel e o prata-cloreto de prata, ambos muito recorrentes em muitas análises potenciométricas e voltamletas.
Eletrodo de calomel
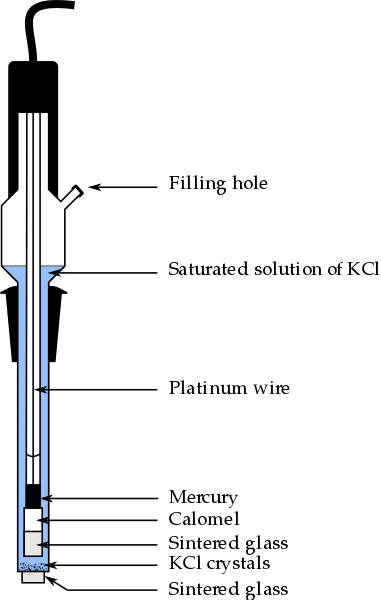 Partes do eletrodo Calomel, um dos eletrodos de referência mais usados em química analítica. Fonte: Bachi-Bouzouk via Wikipedia.
Partes do eletrodo Calomel, um dos eletrodos de referência mais usados em química analítica. Fonte: Bachi-Bouzouk via Wikipedia. Na imagem superior, são mostradas as partes convencionais de um eletrodo de calomel saturado, ecs. Diz -se que está saturado porque contém uma solução saturada de KCl (azul), que também apresenta desenrolados KCL.
A coluna interna, viajada por um fio de platina, é preenchida com mercúrio, que por sua vez entra em contato com uma pasta de calomel, HG2Cl2 Ó cloreto de mercúrio (i) e a solução saturada de KCl. Assim, nesse eletrodo, a concentração dos íons Cl é importante-, Como seu valor modifica o potencial do eletrodo.
A reação que ocorre é a seguinte:
Hg2Cl2(s) + 2e- 2HG (L) + 2Cl-
E tem um eº de 0.241 v.
Na extremidade inferior dos CEs, há um frito poroso, que é colocado em contato elétrico com a solução do analito e permite a troca controlada de íons íons-. Caso contrário, haveria contaminação de cloretos na amostra, e também o eletrodo perderia sua preciosa solução de KCl saturada.
Este eletrodo é usado para medições de pH e, em geral, de qualquer analito cuja concentração possa ser determinada em um meio aquoso.
Pode atendê -lo: álcool térmico: estrutura, propriedades, riscos e usosEletrodo de prata prateado
 Electro de prata de prata. Fonte: Tenofalltrades (Talk) (uploads). / Domínio público
Electro de prata de prata. Fonte: Tenofalltrades (Talk) (uploads). / Domínio público Semelhante ao eletrodo de Calomel, o eletrodo de prata prateado consiste em um fio de prata coberto com cloreto de prata e também submerso em uma solução saturada por uma mistura de KCl e AgCl.
Todas as suas peças estão protegidas em um tubo de plástico, que possui uma abertura porosa através da qual estabelece contato elétrico com a solução.
A reação que define seu potencial, eº = 0.197 V, é o seguinte:
AGCL (s) + e- ⇌ AG (S)+CL-
Este eletrodo apresenta maiores usos e preferências do que o de Calomel, devido ao impacto negativo do mercúrio no meio ambiente. Por outro lado, os eletrodos de prata sólidos prateados são mais simples, seguros e baratos para construir no laboratório.
Dizemos então que o eletrodo de forco prateado substitui o Calomel em muitas de suas aplicações (graus potenciométricos, testes de corrosão, análise eletroquímica, etc.).
É também uma das opções preferidas em biologia e medicina, especialmente para eletrocardiografia e eletroencefalografia, uma vez que a prata ou seu sal são substâncias relativamente tóxicas para o corpo.
Referências
- Dia, r., & Underwood, um. (1965). Química analítica quantitativa. (Quinta ed.). Pearson Prentice Hall.
- Skoog d.PARA., Oeste d.M. (1986). Análise instrumental. (Segunda ed.). Inter -American., México.
- Wikipedia. (2020). Referência de eletrodo. Recuperado de: em.Wikipedia.org
- Elsevier b.V. (2020). Referência de eletrodo. Cientedirect. Recuperado de: ScientEdirect.com
- Química Librettexts. (9 de junho de 2020). Eletrodos de referência. Recuperado de: química.Librettexts.org
- « Alexandria Lighthouse Localização, história, descrição, ruínas
- Emily Dickinson Biography, realizações, obras, frases »

