Reações de eletrofilos, exemplos, eletrofilicidade
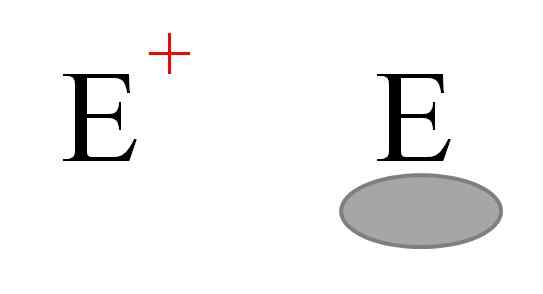
- 1283
- 210
- Gilbert Franecki
A Eletrofilo É tudo o que as espécies químicas (átomo ou molécula) parecem avidamente alguns elétrons. A palavra significa 'amor por elétrons'. Portanto, uma eletrofia sempre tende a ganhar ou aceitar elétrons ao participar de reações químicas.
O que torna um eletrofilo que precisa de elétrons? Você deve ter uma deficiência de elétrons, manifestada por uma carga positiva parcial ou total ou por um produto de vaga eletrônico de um octeto de valência incompleto. Ou seja, temos vários tipos de eletrofilos, embora todos aceitem pares de elétrons de espécies negativas.
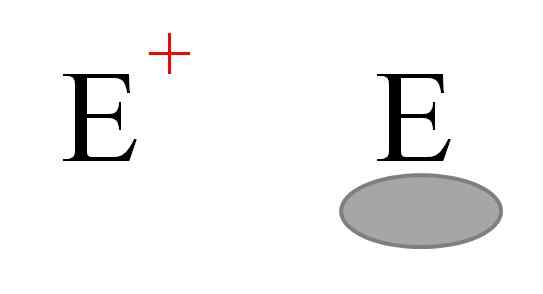 Os dois tipos mais frequentes de eletrofilos na química. Fonte: Gabriel Bolívar.
Os dois tipos mais frequentes de eletrofilos na química. Fonte: Gabriel Bolívar. Dois tipos de eletrofilos geralmente são representados. Ambos são simbolizados com a letra e. Aquele à esquerda corresponde a uma eletrofia de carga positiva e+. Enquanto isso, o da direita corresponde a um eletrofilo com vaga eletrônica, representada por um oval acinzentado que indica a ausência de elétrons em um orbital de Valência.
Cátions de metal são exemplos de eletrofilos e+, bem como alguns íons poliiatômicos como o hidrônio, h3QUALQUER+. Moléculas de Alh3 e BF3, Por outro lado, são exemplos do segundo tipo de eletrofilos, uma vez que o alumínio e o átomo de boro têm uma deficiência de elétrons porque não completam o octeto de Valência.
[TOC]
Reações
Os eletrofilos reagem que aceitam pares de elétrons de átomos com altas densidades negativas, ou seja, rico em elétrons. Esses átomos ou moléculas negativas são chamadas de nucleofilos, nu-, que doam alguns elétrons para a eletrofia e e e+:
Wildebeest- + E+ → Nu-e
Esta é a base teórica para muitas reações orgânicas, como a substituição eletrofílica aromática. O nucleófilo não precisa necessariamente ser um ânion, mas também pode ser uma molécula neutra com um átomo eletronegativo, como o nitrogênio.
Pode atendê -lo: silício: história, propriedades, estrutura, obtenção, usosExemplos de eletrofilos
Ácidos de Lewis
Os ácidos de Lewis são eletrofilos, porque por definição eles aceitam pares de elétrons. Cátions metálicos, Mn+, atrair as regiões negativas das moléculas polares circundantes nos processos de solvatação. Ah simn+ acaba ao redor cargas negativas, até aceitar elétrons para formar complexos de coordenação.
A CUCION CU2+, Por exemplo, é um ácido de Lewis e um eletrofilo porque é coordenado com átomos de oxigênio aquático para formar uma ACU complexa2)62+. Da mesma maneira que acontece com outros cátions.
Nem todos os ácidos de Lewis são cátions: alguns são moléculas ou átomos neutros. Por exemplo, o BF3 É um ácido de Lewis e um eletrofilo porque.
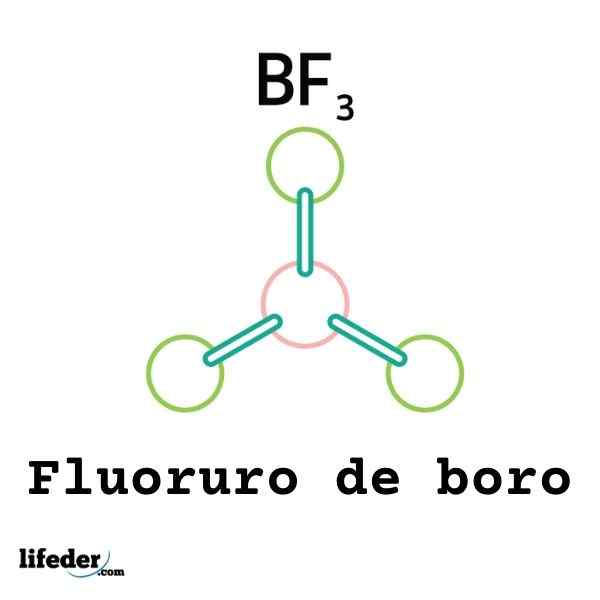
Assim, ele será ligado a um ânion fluoreto circundante para formar o ânion Boro Tetrafluoruro, BF4-. Isto é, o namorado3 forma um link com o f- Ao aceitar alguns de seus elétrons.
Outra eletrofia é o nitronio ion, não2+, que é um Agente eletrofílico muito forte formado nas reações de nitração do benzeno. Nesse íon, o átomo de nitrogênio tem uma carga positiva, então os elétrons de benzeno aceitam rapidamente.
Ácidos Brönsted
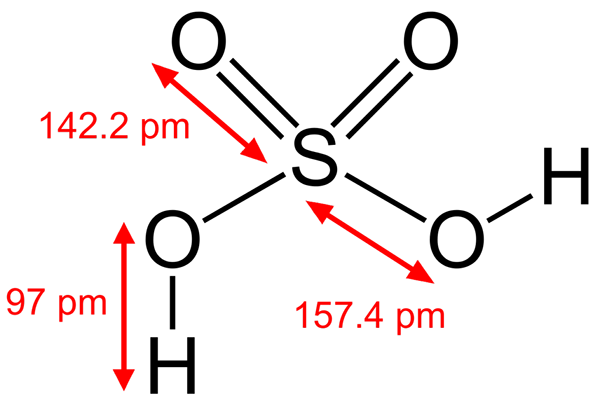 Estrutura do ácido sulfúrico
Estrutura do ácido sulfúrico Alguns ácidos Brönsted também são eletrofilos. Por exemplo, o cátion do hidrônio, h3QUALQUER+, É um eletrofilo porque o átomo de oxigênio tem uma carga positiva. Sendo muito eletronegativo, você procurará ganhar elétrons doando um de seus hidrogênios para se transformar em uma molécula de água.
Outro ácido Brönsted, como o ácido sulfúrico, H2SW4, É também um eletrofil. O átomo de enxofre é altamente oxidado e procurará obter elétrons doando seus dois hidrogênios.
Pode atendê -lo: tetracloreto de carbono (CCL4)Halogênios
Halogênios (f2, Cl2, Br2 e eu2) São eletrofilos. Seus átomos não têm deficiências eletrônicas; No entanto, seus links são instáveis, porque ambos os átomos, X-X, atraem muito fortemente elétrons para eles.
Portanto, os halogênios reagem como agentes oxidantes, se comportando como eletrofilos e aceitando pares de elétrons para se tornarem ânions de halogenidade (F-, Cl-, Br- e eu-).
No entanto, os halogênios não apenas ganham elétrons dessa maneira. Eles também podem estar ligados a menos átomos eletronegativos do que eles para obter um ganho de elétrons líquidos. Por exemplo, esta é a razão pela qual eles podem ser adicionados às duplas ligações de alcenos ou olefinas.
Os halogênios representam um tipo diferente de eletrofia para os dois que foram introduzidos no começo. No entanto, seu comportamento no final é o mesmo que para todos os eletrofilos: aceite pares de elétrons.
Alugue e halogenetos de hidrogênio
 Moléculas de CFC são halogenetos de alquil
Moléculas de CFC são halogenetos de alquil Halogenetos de aluguel e hidrogênio são eletrofilos nos quais o Atom Linked Atom tem uma forte deficiência eletrônica representada pelo símbolo Δ+. Isso ocorre porque o halogênio, altamente eletronegativo, atrai a densidade eletrônica do átomo vizinho para si mesmo.
Para halogenetos alquil, RX, R terá uma deficiência eletrônica enquanto x excesso de elétrons, rδ+-Xδ-. Assim, se uma espécie muito negativa se aproximar do RX, ele atacará r para se vincular a ele e fazer X sair como um ânion.
Além disso, em halogenetos de hidrogênio, HX, o hidrogênio tem uma deficiência eletrônica ou uma carga parcial positiva, hδ+-Xδ-. Portanto, espécies negativas produzirão seus elétrons a esse hidrogênio e ele, como um eletrofilo, os aceitará.
Compostos carbonil
Ácidos, halogênios e halogenes não são as únicas moléculas que podem ser classificadas como eletrofilos. Mesmo se não, dióxido de carbono, CO2, É um eletrofilo, porque o átomo de carbono central é muito oxidado, ou = Cδ+= O.
Pode servir você: frasco de fundo planoPortanto, quando co -2 Reacta fará isso aceitando pares de elétrons, tornando -se o carboxilato, o grupo COOH ou o ânion carbonato, CO32-.
Além de CO2, Compostos carbonil, como cetonas, aldeídos e ésteres também são exemplos de eletrófilos, porque neles carbono tem uma carga parcial positiva e tende a aceitar elétrons de espécies muito negativas.
Carbocações
 Atom de carbono metano carregado positivamente
Atom de carbono metano carregado positivamente As carbocações são extraordinariamente fortes ácidos de Lewis. Existem terciários (r3C+), secundário (r2HC+) ou primário (RH2C+). O carbono sempre forma quatro ligações, então esse cátion em particular buscará como aceitar elétrons de alguma forma.
Eletrofilicidade
Nem todos os eletrofilos estão tão "famintos" por elétrons. Alguns são mais reativos que outros. Quanto maior a deficiência eletrônica de eletrófilos, maior sua sensibilidade aos ataques nucleofílicos de sofrimento de espécies negativas. Isto é, apresentará maior eletrofilidade, que é a medida relativa de como o reativo é o eletrofilo em questão.
Por exemplo, carbocações, nitrônio e fluoreto têm alta eletrofilaity; Enquanto dióxido de carbono ou alguns cátions como sódio têm baixa eletrofilacia.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Eletrofilo. Recuperado de: em.Wikipedia.org
- James Ashenhurst. (2020). Nucleófilos e eletrófilos. Recuperado de: MasterorganicChemistry.com
- Professora Patricia Shaley. (2012). Nucleófilos e eletrófilos. Universidade de Illinois. Recuperado de: butano.Chem.Uiuc.Edu
- Danielle Reid. (2020). Eletrofilo: Definição e Exemplo. Estudar. Recuperado de: estudo.com
- Tim Soderberg. (7 de outubro de 2019). Eletrófilos. Química Librettexts. Recuperado de: química.Librettexts.org
- « Fórmula da lei de Biot-Savart, Demonstração, Aplicações, Exercícios
- Lei de tolerância de Shelford o que consiste e exemplos »

