Clausius clapeyron Equação para que é, exemplos, exercícios

- 2622
- 46
- Ralph Kohler
O Clausius Clapeyron Equação É aquele que relaciona as mudanças na pressão do vapor e na temperatura, em uma fase ou mudança de transição de estado. Se aplica a sublimations, evaporações, fusões ou mesmo em mudanças nas fases cristalinas. Vale ressaltar que esta equação se aplica a uma substância pura que está em equilíbrio.
Essa equação deriva das leis termodinâmicas e diagramas de P-T para uma substância, onde a linha de coexistência é observada; Aquilo que separa duas fases diferentes (vapor líquido, líquido sólido, etc.). Para transferir esta linha, é necessário ganho ou perda de calor, como a entalpia de vaporização, ΔHVAP.
 Clausius Clapeyron Equação. Fonte: Gabriel Bolívar.
Clausius Clapeyron Equação. Fonte: Gabriel Bolívar. A imagem mais alta mostra a equação de Clausius clapeyron antes de ser integrada. Normalmente é geralmente aplicado a sistemas de vapor líquido, onde ΔH é usadoVAP E você deseja calcular qual será a pressão do vapor líquido a uma determinada temperatura. Também serve para calcular o ΔHVAP de um certo líquido em uma faixa de temperatura.
A equação de Clausisu-clapeyron também é usada com bastante frequência para estudar alterações de pressão nos sólidos voláteis; isto é, a entalpia da sublimação é considerada, ΔHsub.
[TOC]
Qual é a equação de Clausisu-clapeyron para?
Cálculo de pressões de pressões e entalpias de vaporização
A partir da equação de Clausius-clapeyron de cima, algumas considerações matemáticas são finalmente feitas para finalmente realizar uma integração. Por exemplo, para um sistema de vapor líquido, supõe-se que ΔHVAP Não varia com a temperatura e que ΔV corresponde exclusivamente ao volume do vapor, desprezando o volume do líquido (vvapor-Vlíquido = Vvapor).
Supondo que o vapor se comporte como um gás e integração ideais, é obtida a equação de Clausius-clapeyron integrada:
Pode atendê -lo: volatilização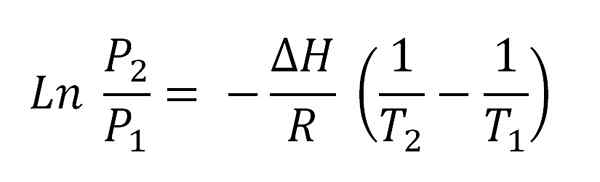 Clausius clapeyron Equação integrada.
Clausius clapeyron Equação integrada. Esta equação corresponde à de uma linha gráfica como:
Ln p vs 1/t
E cuja inclinação negativa é (ΔH/R). Para atender a essa equação, portanto, ΔH deve ser constante no intervalo de temperatura (t2-T1) em que as pressões de vapor são medidas em equilíbrio com o líquido.
Dessa maneira, se for assumido que ΔH varia pouco em pequenos intervalos de temperatura, é possível usar a equação dessa linha para prever alterações na pressão de vapor de um líquido; E ainda mais, você pode determinar seu ΔH de vaporização.
Quanto maiores os intervalos de temperaturas considerados, maior o desvio dessa equação dos dados experimentais, e menos ele será cumprido.
Determinação de mudanças de fase
Assim, a equação de Clausius-Clapeyron se torna o desenvolvimento de uma linha tangente para a linha de coexistência entre duas fases físicas, que é observada em qualquer diagrama de P-T para uma substância.
Se ocorrer uma mudança de fase, haverá uma mudança na inclinação e ΔH não será o mesmo. Portanto, quando desvios fortes são evidenciados e a equação falha, é um sinal de que no intervalo de temperatura a substância está experimentando outra mudança de fase. Isto é, deixa de ser um sistema de vapor líquido, pois é passado para a linha de coexistência correspondente ao balanceamento de líquido sólido ou de vapor sólido.
Use exemplos
- A equação de Clausius clapeyron tem sido usada em meteorologia para estudar o comportamento das nuvens, mesmo aquelas presentes em outros planetas ou luas com atmosferas.
Pode atendê -lo: ácido glucônico: estrutura, propriedades, síntese, usos- Foi usado para determinar a entalpia da fusão de vários metais, como sódio e gálio, e para extrapolar suas pressões de vapor a temperaturas muito altas.
- Também tem sido usado para determinar a entalpia da vaporização de substâncias como cloro gasoso, tetracloreto de carbono, água líquida, gelo e iodo.
- Também serviu para estudar mudanças de fase nas estruturas cristalinas. Neste último exemplo, a equação integrada de Clausius-Clapeyron parece notavelmente diferente, pois as mesmas considerações que são tomadas para o sistema de vapor líquido não podem ser feitas para ΔV. As variações de volume de uma fase para outra desta vez são pequenas.
Exercícios resolvidos
- Exercício 1
A pressão do vapor de gelo é 4.58 Torr a 0 ° C e 1.95 Torr a -10 ° C. Qual é a sua entalpia de sublimação nessa faixa de temperatura?
Observe que temos duas pressões e duas temperaturas:
P1 = 4.58 Torr
P2 = 1.95 Torr
T1 = 0 ° C + 273 = 273 K
T2 = -10 ° C + 273 = 263 K
Convertemos as unidades de temperatura de ° C para K, porque a constante R de gases tem k em suas unidades:
R = 8.314 J/K
Assim, usamos a equação integrada de Clausius-Clapeyron e Clear ΔHsub, o que permaneceria como:
ΔHsub = -Rln (p2/P1) / (1 / t2 - 1 /t1)
Para mais conforto, passará a substituir apenas os números, mas sabendo que a unidade final será o joule:
ΔHsub = -(8.314) LN (1.95/4.58)/(1/263 - 1/273)
= 50.97 J
Ou 51.07 J Considerando poucos decimais. Este valor apresentará oscilações dependendo dos intervalos t2-T1 e de certas pressões de vapor.
- Exercício 2
O ponto de ebulição do etanol a uma pressão de 760 torr (1 atm) é 78.3 ° C, e sua entalpia de vaporização é 39.3 KJ. Qual será a sua pressão de vapor a uma temperatura de 46 ° C?
Pode servir a você: Tantalus: estrutura, propriedades, usos, obtençãoIdentificamos os dados:
P1 = 760 Torr
P2 = ?
T1 = 78.3 ° C + 273 = 351.3 k
T2 = 46 ° C + 273 = 319 K
ΔHVAP = 39.3 kJ ou 39300 J
Então, devemos limpar P2 da equação integrada de Clausius-Clapeyron. Novamente, as unidades serão omitidas para conforto e os cálculos serão desenvolvidos passo a passo:
Ln (p2/P1) = -(ΔHVAP/R) (1/t2 - 1/t1)
Ln (p2/760) = -(39300/8.314) (1/319 - 1/351.3)
Ln (p2/760) = -1.36
Aplicando a função exponencial em ambos os lados da equação para poder limpar P2 nós teremos:
E (Ln P2/760) = e(-1.36)
P2/760 = 0.256
P2 = 0.256 (760)
= 195 Torr
A uma temperatura mais baixa (46 ° C), menor pressão de vapor (195 Torr). De fato, tendo o etanol uma pressão de 760 Torr para 78.3 ° C, estamos falando sobre seu ponto de ebulição normal. Este é o comportamento esperado para todos os líquidos
Em geral, os exercícios de Clausius clapeyron desse tipo consistem em limpeza p2, T2 ou ΔH de vaporização ou sublimação. Os cálculos mudam significativamente quando ΔV também deve ser considerado, especialmente quando se trata de sistemas ou saldos de líquido sólido.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2020). Clausius-clapeyron Relação. Recuperado de: em.Wikipedia.org
- Universidade Estadual de San José. (s.F.). A equação de Clausius clapeyron:
Derivação e aplicação de DSTs em meteorologia. Recuperado de: sjsu.Edu - Grupo Bodner. (s.F.). A equação de Clausius-Clapeyron. Recuperado de: Chemed.Chem.Purdue.Edu
- Chieh c. & Censulo a. (18 de maio de 2020). Clausius Clapeyron Equação. Química Librettexts. Recuperado de: química.Librettexts.org
- Walter J. Moore. (1962). Química Física. (Quarta edição). Longmans.
- « 7 poemas sobre o ambiente de autores conhecidos
- Aprendizagem para teoria da descoberta, exemplos, atividades »

