Estrutura de dióxido de cloro (CLO2), uso, obtenção, risco, propriedades

- 4584
- 953
- Gilbert Franecki
Ele dióxido de cloro É um composto inorgânico formado pelo elemento cloro (CL) e oxigênio (O). Sua fórmula química é CLO2. É um gás amarelo esverdeado a avermelhado. Não é encontrado naturalmente no ambiente.
É extremamente reativo, por isso é comum estar preparado no local onde será usado. Um de seus usos mais importantes é como microbicida, anti -séptico e desodorização, porque elimina bactérias, vírus e fungos com muita facilidade e em concentrações muito baixas.
 Alguns alimentos vendidos em supermercados podem ter sido desinfetados com dióxido de cloro Clo2. Autor: ELASTICCOMPUTEFARM. Fonte: Pixabay.
Alguns alimentos vendidos em supermercados podem ter sido desinfetados com dióxido de cloro Clo2. Autor: ELASTICCOMPUTEFARM. Fonte: Pixabay. Permite desinfetar alimentos como vegetais, frutas, carnes, pássaros e frutos do mar. Serve para higienizar superfícies, pisos, banheiros, sistemas de ventilação, piscinas, equipamentos de laboratório, equipamentos de dentista etc.
Portanto, é usado no processamento de alimentos, em hospitais e clínicas, em indústrias e lojas. É usado para purificar a água usada para beber e também as águas residuais municipais.
É muito eficaz como um agente oxidante, por isso é usado para branquear polpa, óleos, farinha, couro, fibras têxteis, entre outras.
Quando está na forma de gás, é muito perigoso, pois é muito explosivo e é usado principalmente em soluções aquosas. É tóxico se for inalar.
[TOC]
Estrutura
O dióxido de cloro é formado pela união de um átomo de cloro (CL) com dois átomos de oxigênio (O). Os links de cloro com cada oxigênio são covalentes e duplos. O cloro neste composto tem uma valência de +4.
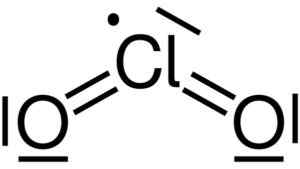 Estrutura de Lewis de dióxido de cloro2. Yikrazuul [domínio público]. Fonte: Wikimedia Commons.
Estrutura de Lewis de dióxido de cloro2. Yikrazuul [domínio público]. Fonte: Wikimedia Commons. Possui uma estrutura simétrica e em forma de ângulo, porque possui elétrons livres. Isto é, eles não formam um link com nenhum outro átomo.
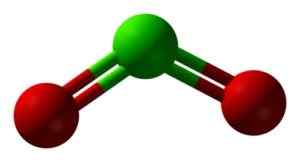 Estrutura clo2 em três dimensões. Verde = cloro; Vermelho = oxigênio. Ben Mills e Jynto [domínio público]. Fonte: Wikimedia Commons.
Estrutura clo2 em três dimensões. Verde = cloro; Vermelho = oxigênio. Ben Mills e Jynto [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
- Dióxido de cloro
- Óxido de cloro (IV)
Propriedades
Estado físico
Amarelo esverdeado a gás amarelo avermelhado.
Peso molecular
67,45 g/mol.
Ponto de fusão
-59 ºC.
Ponto de ebulição
11 ºC.
Densidade
Líquido a 0 ° C = 1.642 g/cm3
Gás = 2,33 (densidade relativa do ar, ar = 1).
Pode servir a você: álcool isoamílico: estrutura, propriedades, usos e riscosSolubilidade
Solúvel em água: 2000 cm3 do clo2 gás a 100 cm3 de água fria ou 0,8 g/100 ml de água a 20 ° C. Solúvel em solução alcalina e em solução de ácido sulfúrico H2SW4.
Propriedades quimicas
O clo2 É extremamente reativo e pode explorar violentamente. É um agente oxidante muito eficaz.
O clo2 Quebra violentamente se entrar em contato com materiais orgânicos. Se você estiver no ar em uma concentração superior a 10%, ele pode explodir devido à luz solar ou calor.
Você também pode detonar na presença de mercúrio (HG) ou monóxido de carbono (CO).
Sob a ação de ultravioleta (UV) ou ozônio, o clo2 Torna -se hexoxido de cloro2QUALQUER6, composto muito instável.
Propriedades de suas soluções aquosas
Suas soluções aquosas são amarelas ou amarelas avermelhadas. Eles são estáveis se permanecerem frios, bem selados e protegidos da luz solar. Na presença de luz, essas soluções são lentamente quebradas para dar ao ácido clorídrico HCl e ao ácido clorico HCLO3.
 Solução de água de CLO2 Onde é observado que um gás amarelo é liberado que é o CLO2. Autor: MaterialScientist. Fonte: Wikimedia Commons.
Solução de água de CLO2 Onde é observado que um gás amarelo é liberado que é o CLO2. Autor: MaterialScientist. Fonte: Wikimedia Commons. Nas soluções alcalinas, o CLO2 É dividido em íons clorito clo2- e CLORATE3-. Nas soluções ácidas, o cloro ácido forma HCLO2 E então isso é dividido no ácido clorídrico HCl e ácido clorico HCLO3.
Outras propriedades
Os vapores concentrados de CLO2 Eles são potencialmente explosivos, por isso não foi possível comprimir nem apenas misturados com outros gases. Por esse motivo, é preferido prepará -lo no local onde será usado.
Quando são temperaturas muito baixas em sua forma hidratada, que é a maneira como às vezes é transferida, é um sólido na forma de um bloco em forma de gelo e laranja.
Tem um cheiro semelhante ao cloro. É tóxico por inalação.
Obtenção
Pode ser obtido de várias maneiras. Por exemplo, em alguns casos, as soluções CLO2 Eles se preparam para passar uma mistura de gás de cloro (CL2) e ar (ou gás de cloro e nitrogênio2) através de uma coluna que contém grânulos de clorito de sódio (naclo2).
Pode atendê -lo: camada de valência2 NACLO2 + Cl2 → 2 NaCl + 2 clo2
O produto gerado contém aproximadamente 90% de CLO2, Entre outros compostos de cloro.
Também é obtido do clorato de potássio (KCLO3) e ácido sulfúrico (H2SW4) Na presença de ácido oxálico como redutor. Nesse caso, o dióxido de carbono também é formado (CO2) que serve para diluir o clo2.
Pode ser preparado no local de uso baseado em clorato de sódio (naclo3), ácido sulfúrico (H2SW4) e metanol (escolha3OH).
Na indústria, é obtido por clorato de sódio (naclo3) e dióxido de enxofre (então2) Na presença de ácido sulfúrico.
2 NACLO3 + SW2 + H2SW4 → 2 clo2 + 2 Nahso4
Usa como desinfetante
Pode ser usado como um poderoso agente antimicrobiano. Verificou -se que é altamente eficaz contra vários microorganismos, como Escherichia coli e ele Staphylococcus aureus.
Com o último, uma concentração de apenas 5 ppm de CLO2 para eliminar 100% deles. É bactericida, anti -séptico e desodorização. É eficaz em um amplo intervalo de pH.
Na comida
É usado como um agente antimicrobiano na água para fumigar frutas e vegetais, no processamento de pássaros de pássaros, carnes vermelhas, pedaços de carne e órgãos e produtos marinhos e frutos do mar.
 A carne vermelha dos supermercados pode ter sido tratada com dióxido de cloro para desinfetá -los. Autor: Karamo. Fonte: Pixabay.
A carne vermelha dos supermercados pode ter sido tratada com dióxido de cloro para desinfetá -los. Autor: Karamo. Fonte: Pixabay. As soluções de dióxido de cloro devem ser usadas em uma concentração que não exceda 3 ppm (partes por milhão) de CLO2 residual, para que não tenha efeito na comida.
Após o tratamento com CLO2 Todos os alimentos devem ser governados completamente com água potável ou devem ser usados como escaldados, cozinhando ou enlatados.
No caso de produtos marinhos, a solução de esgoto2 Deve ser usado na água e no gelo que são usados na enxágue, lavagem, descongelo, transporte ou armazenamento. Os frutos do mar crus devem ser lavados muito bem com água potável antes do consumo.
 Água fria e gelo com os quais as frutas do mar contêm pequenas quantidades de clo2. Autor: Public DomainParturas. Fonte: Pixabay.
Água fria e gelo com os quais as frutas do mar contêm pequenas quantidades de clo2. Autor: Public DomainParturas. Fonte: Pixabay. No papel e papelão que entrarão em contato com a comida
Soluções CLO2 Eles são usados para eliminar microrganismos que causam Slim (como algas, bactérias e fungos) no processo de água usada na fabricação de papel e papelão que entrarão em contato com os alimentos.
Pode atendê -lo: moléculas apolaresEm água potável
Serve para purificar a água e torná -lo potável (seguro para beber). É usado no pré -tratamento da água que será engarrafado para beber ou água que será usado como ingrediente na fabricação de bebidas ou refrigerantes.
 Alguns refrigerantes processados podem conter água tratada com clo2. Susan Slater [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Alguns refrigerantes processados podem conter água tratada com clo2. Susan Slater [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Em odontologia
É usado nos instrumentos usados pelo dentista ou dentista para desinfetá -los e destruir organismos de patógenos neles.
Em aplicações médicas
As soluções aquosas de CLO2 Eles foram usados para tratar a candidíase oral (infecção pela boca). Candidíase é uma infecção por fungos Candida Albicans.
 Aparência de fungos de Candida albicans em uma safra de laboratório. CDC/DR. William Kaplan [domínio público]. Fonte: Wikimedia Commons.
Aparência de fungos de Candida albicans em uma safra de laboratório. CDC/DR. William Kaplan [domínio público]. Fonte: Wikimedia Commons. O dióxido de cloro elimina a boca da boca e melhora significativamente a aparência de tecidos orais sem efeitos colaterais.
Alguns pesquisadores médicos indicam que as soluções CLO2 Aplicados às operações cirúrgicas feridas, elas podem diminuir ou suprimir a formação de acessos sem afetar a cura do mesmo, com a vantagem adicional de suas propriedades anti -sépticas.
Outros usos
Por suas propriedades oxidantes e microbicidas, o CLO2 se utiliza para:
- Branquear a celulose da madeira na fabricação de polpa e papel, fornecendo um brilho estável.
- Decorar gorduras e óleos, couro, farinha esbranquiçada e têxteis.
- Aplicações agrícolas, como desinfetar superfícies duras, equipamentos, sistemas de água e estufas de cogumelos.
- Aplicações em indústrias, lojas e hospitais, como desinfetar superfícies duras (paredes, pisos, banheiros), sistemas de ventilação, equipamentos de laboratório.
- Desinfetar apartamentos e banheiros de famílias, sistemas de ar condicionado, sistemas de circulação de água de natação.
- O tratamento de águas residuais municipais e industriais.
- Limpeza de poluição de campos de petróleo.
- Fabricação de sais de cloreto (CL-).
Riscos
- Os vapores concentrados de CLO2 Eles são potencialmente explosivos.
- É tóxico por inalação e ingestão. É irritante olho, nariz e garganta, pode causar edema pulmonar e bronquite crônica.
- De acordo com as fontes consultou o CLO2 não causa mutações no DNA ou causa câncer em humanos.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Dióxido de cloro. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Dean, J.PARA. (editor). (1973). Manual de Química de Lange (décima primeira edição). McGraw-Hill Book Company.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Vch verlagsgellschaft mbh.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Bajpai, p. (2012). Branqueamento de dióxido de cloro. Efeito do branqueamento de dióxido de cloro na qualidade da polpa. Em abordagens ambientalmente benignas para branqueamento de celulose (segunda edição). Recuperado de cientedirect.com.
- Moran, s. (2018). Química da água. Dióxido de cloro. Em um guia aplicado para o projeto da estação de tratamento de água e efluente. Recuperado de cientedirect.com.
- McKen, l. (2012). Introdução à radição de alimentos e esterilização médica. Diexido de corina a gasóia. No efeito da esterilização em plásticos e elastômeros (terceira edição). Recuperado de cientedirect.com.
- « Características paleolíticas superiores, arte, organização social
- Estrutura do ácido sulfônico, nomenclatura, propriedades, usa »

