Estrutura do ácido sulfônico, nomenclatura, propriedades, usa
- 4087
- 369
- Alfred Kub
Se denomina ácido sulfônico Em todo o composto pertencente a uma família de ácidos orgânicos que têm um ou mais grupos -então3H. Certos autores indicam que o composto pai é H-S (= O)2-Oh, ou h-so3H, chamado por algum "ácido sulfônico", no entanto, sua existência não foi comprovada, nem a de seu tautômero ho -s (= o) -oh conhecido como "ácido de enxofre" (h2SW3), nem em solução nem em estado sólido.
O último é porque o gás de dióxido de enxofre (iv) (então2) Em solução aquosa, torna -se íons bissulfitos (HSO3-) e pirossulfito (s2QUALQUER52-) E não para H-S (= O)2-Oh ou ho -s (= o) -oh, o que já foi comprovado por muitos pesquisadores químicos.
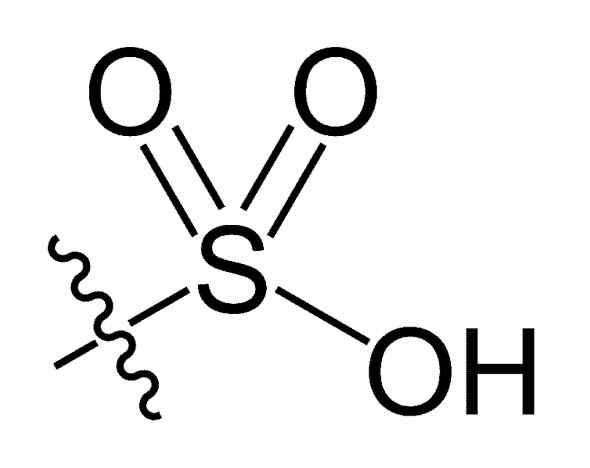
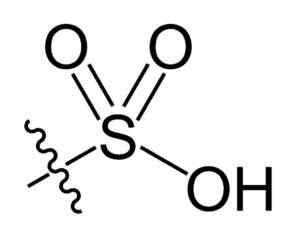 Grupo Sulfonil. Choij [domínio público]. Fonte: Wikipedia Commons
Grupo Sulfonil. Choij [domínio público]. Fonte: Wikipedia Commons Na fórmula R-So Chemical3H de ácidos sulfônicos, o Grupo R pode representar esqueletos de hidrocarbonetos, como Alkane, Alqueno, Alcheno e/ou Areia. Estes podem conter funcionalidades secundárias como éster, éter, cetona, amino, amido, hidroxila, carboxil e grupos de fenol, entre muitos outros.
Os ácidos sulfônicos são ácidos fortes, comparáveis ao ácido sulfúrico (H2SW4). No entanto, o restante de suas propriedades depende em grande parte da natureza do grupo R.
Alguns tendem a dessulfonar em altas temperaturas. Isso significa perder o grupo -então3H, especialmente quando R é um arenoso, isto é, com anel benzeno.
Os ácidos sulfônicos têm muitos usos, dependendo de sua fórmula química. Eles são usados para fabricar corantes, tintas, polímeros, detergentes, surfactantes e catalisadores, entre muitas outras aplicações.
[TOC]
Estrutura
Os ácidos sulfônicos têm a seguinte estrutura geral:
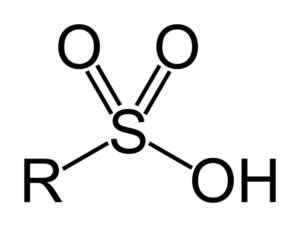 Fórmula geral de ácidos sulfônicos. Benjah-BMM27 [domínio público]. Fonte: Wikipedia Commons
Fórmula geral de ácidos sulfônicos. Benjah-BMM27 [domínio público]. Fonte: Wikipedia Commons Nomenclatura
- Grupo Sulfonil: -So3H
- Ácido alugado ou arilsulfônico: r-so3H
Propriedades
Eles são sólidos ou líquidos, dependendo do grupo R. Nenhum ácido sulfônico gasoso é conhecido.
Suas propriedades físicas e químicas dependem da natureza do grupo R. Como comparação, existem algumas propriedades físicas de vários ácidos sulfônicos, onde P.F. É o ponto de fusão e P.e. É o ponto de ebulição a uma pressão de 1 mm Hg:
- Ácido metanossulfônico: P.F. 20 ºC; p.e. 122 ºC
- Ácido etanosofônico: P.F. -17 ºC; p.e. 123 ºC
- Ácido proposulfônico: p.F. -37 ºC; p.e. 159 ºC
- Ácido butanossulfônico: p.F. -15 ºC; p.e. 149 ºC
Pode atendê -lo: cloreto ferroso (FECL2): estrutura, usos, propriedades- Ácido pentosulfônico: P.F. -16 ºC; p.e. 163 ºC
- Ácido hexanossulfônico: P.F. 16 ºC; p.e. 174 ºC
- Ácido benzefônico: p.F. 44 ºC; p.e. 172 ºC (a 0,1 mm Hg)
- Ácido p-toluensulfônico: p.F. 106 ºC; p.e. 182 ºC (a 0,1 mm Hg)
- Ácido 1-naftalensulnico: P.F. 78 ºC; p.e. Se decompõe
- 2-naftalensulfônico de ácido: p.F. 91 ºC; p.e. Se decompõe
- Ácido trifluorometanossulfônico: P.F. nenhum; p.e. 162 ºC (a 760 mm Hg)
A maioria é muito solúvel em água.
Os ácidos sulfônicos são ainda mais ácidos que os ácidos carboxílicos. Eles têm acidez semelhante à do ácido sulfúrico. Eles se dissolvem em hidróxido de sódio aquoso e bicarbonato aquoso.
Eles tendem a sofrer decomposição térmica, ocorrendo sua dessulfonação. No entanto, vários dos ácidos alcosulfônicos são termicamente estáveis. Em particular, o ácido trífico, ou o ácido trifluorometanesulfônico, é um dos ácidos mais fortes e mais estáveis.
Obtenção
Ácidos arilsulfônicos
Os ácidos ailsulfônicos são geralmente obtidos através do processo de sulfonação que consiste em adicionar um excesso de ácido sulfúrico de fumaça (H2SW4 + SW3) Para o composto orgânico que queremos sulfonar. Por exemplo, no caso de benzeno:
C6H6 + H2SW4 C6H5SW3H + h2QUALQUER
ARH + H2SW4 Arso3H + h2QUALQUER
A sulfonação é uma reação reversível, porque se adicionarmos ao ácido benzeulfônico um ácido diluído e passarmos a vapor na mistura3 E o benzeno é destilado por volatilização com vapor, deslocando o equilíbrio em direção à dessulfonação.
O agente sulfonante também pode ser ácido clorossulfúrico, ácido sulfâmico ou sulfito.
Ácidos alquilofônicos
Estes são geralmente preparados por sulfo-oxidação, ou seja, tratamento de compostos alquil com dióxido de enxofre assim2 e oxigênio ou2, ou diretamente com trióxido de enxofre assim3.
Rh + 2so2 + QUALQUER2 + H2Ou r-so3H + h2SW4
Formulários
Ácidos sulfônicos para surfactantes e detergentes
Os ácidos alckbenphic são usados na fabricação de detergentes, sendo um dos usos mais difundidos.
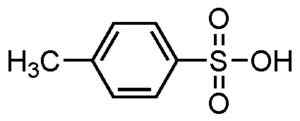 Ácido p-metilbenzefônico. Su-no-g. Fonte = auto -feito. *Data = 21 de agosto de 2006. *Feito com chemdraw. Fonte: Wikipedia Commons.
Ácido p-metilbenzefônico. Su-no-g. Fonte = auto -feito. *Data = 21 de agosto de 2006. *Feito com chemdraw. Fonte: Wikipedia Commons. Eles são usados para detergentes em pó e líquido, detergentes para tarefas pesadas ou leves, mãos e sabonetes de shampoo.
Os componentes ativos são geralmente os ésteres graxos lineares e sulfonados alckybenzeno.
Como os surfactantes são comuns de alfa-olefina sulfonatos, sulfobetinas, sulfossuccinatos e dissulfonatos de Étere alugado difnílicos, todos derivados de ácidos sulfônicos.
Pode atendê -lo: oxalato de sódio (Na2C2O4): estrutura, propriedades, usos, riscosEsses surfactantes encontram uso em produtos de limpeza doméstica, cosméticos, polimerização em emulsões e fabricação química para agricultura.
Os ligsulfonatos são derivados de lignina, um componente de madeira, e são usados como agentes de dispersão, hidratação e ligação em pavimentos de estrada, aditivos de concreto e aditivos em alimentos de origem animal.
Um ácido 2-naftalanossulfônico derivado é usado para aumentar a fluidez e a força do cimento.
Coloração à base de ácido sulfônico
Estes são geralmente caracterizados por contendo grupos azo (r-n = n-r).
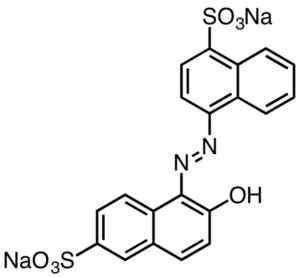 Coloração vermelha ácida. Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikipedia Commons.
Coloração vermelha ácida. Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikipedia Commons. Os corantes derivados de ácido sulfônico têm utilidade na indústria de papel, tintas como impressão de injeção, têxteis como algodão e lã, cosméticos, sabonetes, detergentes, comida e couro.
Um derivado de ácido 2-naftalanossulfônico também é usado como ingrediente para colorir para fibras de poliéster e bronzeamento de couro.
Amidas baseadas em ácidos sulfônicos
Este aplicativo destaca os ácidos acrilamidefônicos, que têm polímeros usados, em eletrodo de metal, como surfactantes e em revestimentos anti -Comcompanions transparentes.
Eles também são usados na melhoria da recuperação de petróleo, como agentes que lança compostos no solo, em misturas de cimento hidráulico e como resinas aminoplásticas que cura os aceleradores.
Algumas sulfonamidas também são usadas em fórmulas de inseticida.
Ácidos sulfônicos fluorados e clorofluidos
Este grupo destaca o ácido trifluorometanossulfônico (cf3SW3H), também chamado de ácido grande. Este composto possui uma catálise de reações de síntese e polimerização orgânica.
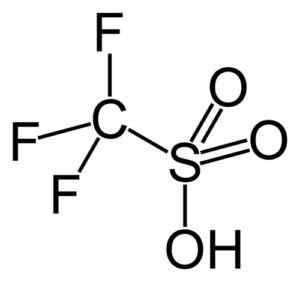 Ácido livre. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons.
Ácido livre. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons. Por exemplo, é usado na polimerização de olefinas aromáticas e na preparação de hidrocarbonetos parafinices altamente ramificados com um número de octano alto para usá -los como aditivos de combustível.
Outra de suas aplicações está na síntese de polímeros condutores, por meio de doping de poliacetileno, produzindo, por exemplo, tipo semicondutores p.
Ácido pentafluoroetanossulfônico (cf3Cf2SW3H), conhecido como ácido pentaplico, é usado como catalisador orgânico.
O ácido grande está reagindo com o pentafluoreto antimônio (SBF5) gerar o "ácido mágico" de tão gotado, um catalisador super -ácido que serve para alquilação e polimerização.
Pode atendê -lo: Tintura de iodo: propriedades, usos, contra -indicaçõesNafion-H é uma resina de troca iônica de um ácido sulfônico polimérico perfumado. Tem a característica de ser inerte em relação a ácidos fortes, bases fortes e agentes reduzidos ou oxidantes.
Em aplicações biológicas
Um dos poucos ácidos sulfônicos encontrados na natureza é o ácido 2-aminoetanossulfônico, mais conhecido como tourada, um aminoácido essencialmente para gatos.
As touradas sintéticas e naturais são usadas como suplementos em alimentos para animais de estimação e produtos farmacêuticos.
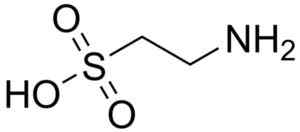 Molécula de tourada. Harbinary. Fonte: Wikipedia Commons
Molécula de tourada. Harbinary. Fonte: Wikipedia Commons O ácido taurocólico é um componente biliar e participa da digestão de gorduras. O ácido 8-anilino-1-naftalanossulfônico, um composto sintético, é usado no estudo de proteínas.
Copolímeros de uréia e ácido bifenildisulfônico têm sido usados como inibidores do vírus do herpes simplex.
Alguns derivados de ácido sulfônico, como poliestireno sulfonado e outros azocompiestos, mostraram propriedades de inibição da imunodeficiência humana ou vírus do HIV, sem ser excessivamente tóxico contra células hospedeiras.
Na indústria de petróleo
Certas misturas de derivados de petróleo, que incluem uma combinação variada de aromáticos, parafinas e aromáticos polinucleares, podem ser sulfados e depois neutralizados adequadamente, gerando os sulfonatos de óleo de som e tão chamados.
Esses sulfonatos de petróleo têm a propriedade de diminuir a tensão da cirurgia na água. Além disso, sua produção tem um custo muito baixo.
Por esse motivo, os sulfonatos de petróleo são injetados nos poços de petróleo existentes, ajudando a recuperação de petróleo bruto que é ocluído entre rochas sob a superfície.
Na formulação de lubrificantes e anticorrosivos
Os sulfonatos de magnésio têm amplo uso em fórmulas de lubrificante, como aditivos de dispersão e para evitar o desgaste.
Os sulfonatos de bário são usados em lubrificantes anti -flint para usos usados em aplicativos de alta velocidade. Os sulfonatos de sódio e cálcio têm lubrificantes e gorduras gordas para melhorar as propriedades de pressão extrema.
Os sais de magnésio do ácido sulfônico também são úteis em aplicações anticorrosivas, como revestimentos, gorduras e resinas.
Referências
- Falk, Michael e Gigure, Paulo A. (1958). Sobre a natureza do ácido sulfuroso. Canadian Journal of Chemistry, vol. 36, 1958. Recuperado do NRCRearchPress.com
- Betts, r.H. e Voss, r.H. (1970). A cinética da troca de oxigênio entre o íon sulfito e a água. Canadian Journal of Chemistry, vol. 48, 1970. Recuperado do NRCRearchPress.com
- Algodão, f.PARA. E Wilkinson, G. (1980). Química inorgânica avançada. Quarta edição. Capítulo 16. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Volume 23. Quarta edição. John Wiley & Sons.
- Kosswig, Kurt. (2012). Surfactantes. Enciclopédia de Ullmann de Química Industrial Vol. 35. Wiley-VCH Verlag GmbH & Co.
- « Estrutura de dióxido de cloro (CLO2), uso, obtenção, risco, propriedades
- Estrutura de ácido poláctico, propriedades, síntese, usa »

