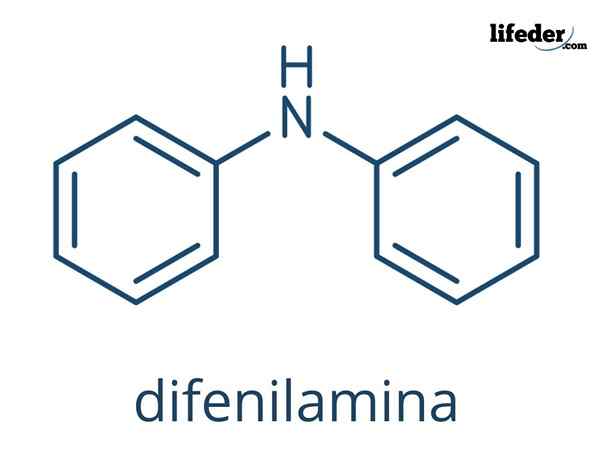
Difenilamina
- 1773
- 39
- Alfred Kub
Qual é a defilamina?
O Difenilamina É um composto orgânico cuja fórmula química é (c6H5)2NH. Seu nome indica que é uma amina, assim como sua fórmula (-nh2). Por outro lado, o termo "difnil" refere -se à presença de dois anéis aromáticos ligados ao nitrogênio. Consequentemente, a desfilamina é uma amina aromática.
Dentro do mundo dos compostos orgânicos, a palavra aromática não está necessariamente relacionada à existência de seus cheiros, mas a características que definem seus comportamentos químicos contra certas espécies.

No caso da difenilamina, sua aromaticidade e o fato de seu sólido apresentar um aroma distinto coincidem. No entanto, a base ou os mecanismos que governam suas reações químicas podem ser explicadas por seu caráter aromático, mas não por causa de seu agradável aroma.
Sua estrutura química, basicidade, aromaticidade e interações intermoleculares são as variáveis responsáveis por suas propriedades: desde a cor de seus cristais até sua aplicabilidade como agente antioxidante.
Estrutura química de defilamina

Nas imagens superiores, as estruturas químicas da difnilamina são representadas. As esferas pretas correspondem a átomos de carbono, brancos a átomos de hidrogênio e azul ao átomo de nitrogênio.
A diferença entre as duas imagens é o modelo de como elas representam a molécula graficamente. Na parte inferior, destaca a aromaticidade dos anéis com as linhas pontilhadas em preto e, também, a geometria plana desses anéis é evidenciada.
Nenhuma das duas imagens mostra o par solitário de elétrons não compartilhados no átomo de nitrogênio. Esses elétrons estão "caminhando" pelo sistema π conjugado das ligações duplas nos anéis. Este sistema forma um tipo de nuvem circulante que permite interações intermoleculares; isto é, com outros anéis de outra molécula.
Pode servir a você: Termômetro de laboratório: características, para que serve, uso, exemplosO exposto acima significa que o torque de nitrogênio não compartilhado está andando por ambos os anéis, distribuindo neles sua densidade eletrônica e depois retornam ao nitrogênio, para repetir o ciclo novamente.
Nesse processo, a disponibilidade desses elétrons diminui, resultando em uma diminuição na basicidade da dipelamina (sua tendência a doar elétrons como base de Lewis).
Usos/aplicações de dipenilamina
A difenilamina é um agente oxidante capaz de cumprir uma série de funções, e entre elas estão as seguintes:
- Durante seu armazenamento, maçãs e peras experimentam um processo fisiológico chamado escaldante, relacionado à produção de trienos conjugados, o que leva a danos na pele das frutas. A ação da dipenilamina permite aumentar o período de armazenamento, reduzindo os danos causados por frutos para 10 % do que é observado em sua ausência.
- Ao combater a oxidação, a difenilamina e seus derivados estendem o funcionamento dos motores, evitando o espessamento do óleo usado.
- A difenilamina é usada para limitar a ação do ozônio na fabricação de borracha.
- A difenilamina é usada na química analítica para detecção de nitrato (não3-), Cloratos (CLO3-) e outros agentes oxidantes.
- É um indicador usado em testes de detecção de envenenamento por nitrato.
- Quando o RNA é hidrolisado por uma hora, ele reage com a desfilamina; Isso permite sua quantificação.
- Na medicina veterinária, a pilamina do dipeiro é usada topicamente na prevenção e tratamento das manifestações do verme da borerida na criação de animais.
- Alguns dos derivados de Duelamine pertencem à categoria de medicamentos anti-inflamatórios não esteróides. Eles também podem ter efeitos farmacológicos e terapêuticos, como antimicrobiano, analgésicos, anticonvulsivantes e atividade anti -câncer.
Preparação de dipenilamina
Naturalmente, a defilamina é produzida na cebola, nos cilantros, nas folhas do chá verde e preto, e nas conchas dos frutos cítricos. Sinteticamente, existem muitas rotas que levam a esse composto, como:
Desaminação térmica de anilina
É preparado pela desaminação térmica de anilina (c6H5NH2) Na presença de catalisadores oxidantes.
Se a anilina nessa reação não incorpora um átomo de oxigênio à sua estrutura, por que você oxida? Porque o anel aromático é um grupo de atratores eletrônicos, ao contrário do átomo H, que doa sua baixa densidade eletrônica de nitrogênio na molécula.
2 c6H5NH2 => (C5H5)2 NH+NH3
Além disso, a anilina pode reagir com sal de cloridrato de anilina (c6H5NH3+Cl-) sob um aquecimento de 230 ºC por vinte horas.
C6H5NH2 + C6H5NH3+Cl- => (C5H5)2 NH
Reação de fenotiazina
A dipenilamina se origina vários derivados quando combinados com diferentes reagentes. Uma delas é a fenotiazina, que, sintetizando com enxofre é um precursor de derivados com ação farmacêutica.
(C6H5)2NH +2S => s (C6H4) NH +H2S

Propriedades de dipenilamina
A dipenilamina é um sólido cristalino branco que, dependendo de suas impurezas, pode adquirir tons de bronchneal, âmbar ou amarelo. Tem um aroma de flor agradável, tem um peso molecular 169,23 g/mol e uma densidade de 1,2 g/ml.
As moléculas desses sólidos interagem por forças de van der Waals, entre as quais as pontes de hidrogênio formadas por átomos de nitrogênio (NH-NH) e o empilhamento de anéis aromáticos, apoiando suas "nuvens eletrônicas" uma no outro.
Pode atendê -lo: sulfeto de zinco (ZnS)Como anéis aromáticos ocupam muito. O acima faz com que o sólido não tenha um ponto de fusão muito alto (53 ºC).
No entanto, no estado líquido, as moléculas são mais separadas e a eficácia das pontes de hidrogênio melhora. Da mesma forma, a desfilamina é relativamente pesada, precisando de muito calor para se mover para uma fase gasosa (302 ºC, seu ponto de ebulição). Isso também se deve em parte ao peso e às interações dos anéis aromáticos.
Solubilidade e basicidade
É muito insolúvel em água (0,03 g/100 g de água) devido ao caráter hidrofóbico de seus anéis aromáticos. Em vez disso, é muito solúvel em solventes orgânicos como o benzeno, tetracloreto de carbono (CCL4), acetona, etanol, piridina, ácido acético, etc.
Sua constante de acidez (PKA) é 0,79, que se refere à acidez de seu ácido conjugado (c6H5NH3+). O próton adicionado ao nitrogênio tem uma tendência a se separar, porque o par de elétrons com os quais está ligado pode percorrer os anéis aromáticos. Assim, alta instabilidade c6H5NH3+ Reflete a baixa basicidade da difnilamina.
Referências
- A Corporação Lubrizol. (2018). Antioxidantes de difenilamina. Recuperado de Lubrizol.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Aplicações farmacológicas da difenilamina e seu derivado como potente composto bioativo: uma revisão. Compostos bioativos atuais, volume 13.
- Prepchem. (2015-2016). Preparação de difenilamina. Recuperado de prepchem.com
- PubChem. (2018). Difenilamina. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Wikipedia. (2018). Difenilamina. Recuperado de.Wikipedia.org

