Cloreto de estrôncio (SRCL2)
- 3133
- 36
- Lonnie MacGyver
O que é cloreto de estrôncio?
Ele Cloreto de estrôncio É um composto inorgânico formado por Strontium, Alkalinoterreo Metal (SR. Becamgbara) e halogênio de cloro. Como ambos os elementos têm eletronegatividades muito diferentes, o composto é um sólido iônico cuja fórmula química é SRCL2.
Como é um sólido iônico, é composto de íons. No caso de SRCL2, Eles são um cátion SR2+ Para cada dois ânions cl-. Suas propriedades e aplicações são semelhantes ao cloreto de cálcio e bário.
Como cloreto de cálcio (CACL2), é higroscópico e seus cristais absorvem a água para formar sal hexa -hidrato, no qual seis moléculas de água estão presentes na treliça cristalina (SRCL2· 6h2QUALQUER). De fato, a disponibilidade do hidrato é maior que o SRCL2 anidro (sem água).
Uma de suas principais aplicações é como precursor de outros compostos de estrôncio; isto é, constitui a fonte de estrôncio em certa síntese química.
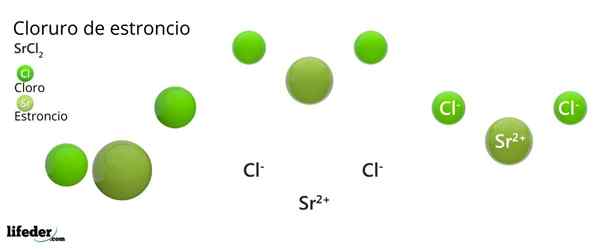
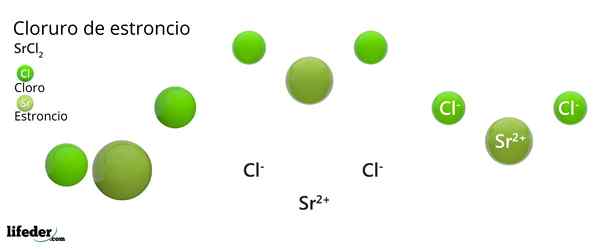
Estrutura química do cloreto de estrôncio
 Estrutura cristalina de cloreto de estrôncio
Estrutura cristalina de cloreto de estrôncio A imagem superior representa o tipo de estrutura cristalina deformada do SRCL2 anidro. Nisso, pequenas esferas verdes correspondem a íons SR2+, Enquanto as volumosas esferas verdes representam os íons cl-.
Nesta estrutura, cada íon sr2+ É "preso" por oito íons cl-, Consequentemente, ter um número de coordenação igual a 8 e, possivelmente, uma geometria cúbica ao redor. Ou seja, quatro esferas verdes fazem o teto do cubo, enquanto os outros quatro no chão, localizados o SR2+ No centro disso.
Qual seria a estrutura da fase de refrigerante? A estrutura de Lewis para este sal é CL-SR-CL, aparentemente linear e assumindo cem por cento de seus links. No entanto, em uma fase gasosa -srcl2(g)- Esta "linha" mostra um ângulo de aproximadamente 130 °, na verdade sendo um tipo de V.
Pode servir a você: Estado gasoso: características, direito geral, exemplosEssa anomalia não pôde ser explicada com sucesso, considerando o fato de que o estrôncio não possui elétrons compartilhados que ocupam volume eletrônico. Talvez possa ser causado pela participação de um orbital D nos links ou a um distúrbio do elétron do núcleo.
Usos/aplicações de cloreto de estrôncio
O srcl2· 6h2Ou tem sido usado como aditivo em polímeros orgânicos; Por exemplo, em álcool polivinílico, a fim de modificar suas propriedades mecânicas e elétricas.
É usado como uma ferrita de estrôncio na fabricação de ímãs de cerâmica e vidro destinados a tornar o cristal da frente da televisão.
Reage com cromato de sódio (NA2CRO4) para produzir cromato de estrôncio (srcro4), que é usado como tinta resistente à corrosão para alumínio.
Quando são aquecidos com fogo, os compostos de estrôncio brilham com uma chama avermelhada, e é por isso que eles estão destinados à elaboração de explosões e fogos de artifício.
Aplicações medicinais
O radioisótopo do cloreto de estrôncio 89 (o isótopo mais abundante é o 85Senhor.
O uso de soluções diluídas (3-5 %) por mais de duas semanas no tratamento da rinite alérgica (inflamação crônica da mucosa nasal) mostra melhorias na diminuição de espirros e fricções nasais.
Uma vez usado em formulações de pasta dentadas para reduzir a sensibilidade dental, formando uma barreira em microtúbulos dentinários.
Estudos deste composto demonstram uma eficácia terapêutica em comparação com a prednisolona (metabolito de medicamentos para prednisona) no tratamento da colite ulcerosa.
Pode servir a você: fração molar: como é calculado, exemplos, exercíciosSeus resultados são baseados no modelo dos ratos; Mesmo assim, representa esperança para os pacientes que também sofrem de osteoporose, pois podem ir ao mesmo medicamento para combater as duas doenças.
É usado para sintetizar o sulfato de estrôncio (SRSO4), ainda mais denso que o SRCL2. No entanto, sua solubilidade mínima de água não torna leve o suficiente para ser aplicado em radiologia, ao contrário do sulfato de bário (Baso4).
Preparação de cloreto de estrôncio
O cloreto de estrôncio pode ser preparado por ação direta do ácido clorídrico (HCl) em metal puro, ocorrendo assim uma reação do tipo redox:
MR (S) + HCl (AC) => SRCL2(AC) + H2(g)
Aqui, o metal estrôncio é oxidado doando dois elétrons para permitir a formação de hidrogênio gasoso.
Além disso, hidróxido e carbonato de estrôncio (SR (OH)2 e SRCO3) reaja com este ácido sintetizando -o:
SR (OH)2(S) + 2HCl (AC) => SRCL2(AC) + 2h2Ou (l)
SRCO3(S) + 2HCl (AC) => SRCL2(AC) + CO2(g) + h2Ou (l)
Aplicando técnicas de cristalização, o SRCL é obtido2· 6h2QUALQUER. Depois de desidratado por ação térmica até que o SRCL finalmente produza2 anidro.
Propriedades do cloreto de estrôncio
As propriedades físicas e químicas deste composto dependem se está em sua forma hidratada ou anidra. Isso ocorre porque as interações eletrostáticas mudam à medida que as moléculas de água são adicionadas à rede cristalina do SRCL2.
Anidro
O cloreto de estrôncio é um sólido cristalino branco, com um peso molecular de 158,53 g/mol, e uma densidade de 3,05 g/ml.
Seus pontos de fusão (874 ºC) e ebulição (1250 ºC) são altos, indicativos das fortes interações eletrostáticas entre os íons SR2+ e cl-. Também reflete a grande energia reticular cristalina que sua estrutura anidro.
Pode atendê -lo: acetato de celuloseEntalpia da formação de SRCL2 sólido é 828,85 kJ/mol. Isso se refere à energia térmica liberada por cada toupeira formada a partir de seus componentes em seus estados padrão: cloro e gás sólido para estrôncio.
Hexa -hidrato
Na forma de hexa -hidrato, ele tem um peso molecular mais alto do que sua forma anidro (267 g/mol) e uma densidade mais baixa (1,96 g/ml). Essa diminuição em sua densidade se deve ao fato de que as moléculas de água "dilatam" os cristais, aumentando o volume; Portanto, a densidade da estrutura diminui.
É quase duas vezes denso que a água à temperatura ambiente. Sua solubilidade de água é muito alta, mas em etanol é levemente solúvel. Isso se deve ao seu caráter orgânico, apesar de sua polaridade. Isto é, o hexa -hidrato é um composto polar inorgânico. Finalmente, a 150 ºC, fica desidratado para produzir sal anidro:
Srcl2· 6h2Ou (s) => srcl2(s) + 6h2O (G)
Referências
- Wikipedia. (2018). Cloreto de estrôncio. Recuperado de.Wikipedia.org
- DrugBank. (2018). Cloreto de estrôncio SR-89. DrugBank recuperado.AC
- PubChem. (2018). Cloreto de estrôncio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov
- Touro. Mater. (2010). Influência do cloreto granular de estontium como aditivos nas propriedades elétricas e mecânicas submarinas para álcool polivinílico puro. Sci., Vol. 33, não. 2, pp. 149-155. Academia Indiana de Ciências.
- Ccoil. (4 de setembro de 2009). Stontium-cloreto -xtal-3D-SF. [Figura]. Recuperado em 13 de abril de 2018, de: Commons.Wikimedia.org
- Todas as reações. SRCL2 - Cloreto de Stontium. Recuperado de todas as reações.com