Estrutura de diclorometano, propriedades, usos, toxicidade
- 4005
- 1180
- Gilbert Franecki
Ele diclorometano, Também conhecido como cloreto de metileno, é um composto orgânico cuja fórmula química é CH2Cl2. Especificamente, é um halogento de alquil derivado de gás metano. Ao contrário do metano, este composto é um líquido incolor e polar.
Foi inicialmente sintetizado em 1839 pelo químico e físico francês Henri Victor Regnault (1810-1878), que conseguiu isolá-lo de uma mistura de cloro e clorometano exposto à luz solar.
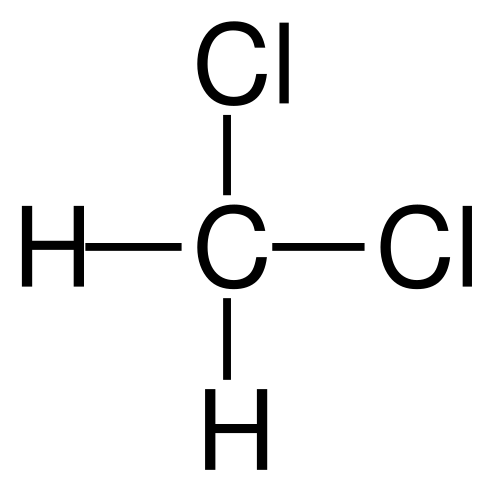 Fórmula estrutural do diclorometano. Fonte: Jü [domínio público]
Fórmula estrutural do diclorometano. Fonte: Jü [domínio público] O diclorometano ocorre industrialmente pelo tratamento de metano ou clorometano com gás de cloro a alta temperatura (400-500 ºC). Juntamente com o diclorometano, eles ocorrem no processo de clorofórmio e tetracloreto de carbono, que são separados por destilação.
O diclorometano é usado como um solvente que permite a soldagem de materiais plásticos e degradar metais. Também é usado em decaffein de café e chá.
O diclorometano é um composto tóxico que pode produzir por inalação irritação das narinas e garganta. Danos hepáticos foram relatados em trabalhadores expostos a altas concentrações do diclorometano. Além disso, ele é agente mutagênico, suspeito de ser carcinogênico.
[TOC]
Estrutura
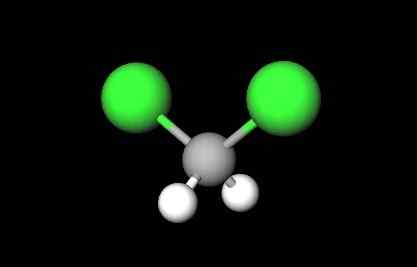
 Estrutura molecular do diclorometano. Fonte: Gabriel Bolívar via Molview.
Estrutura molecular do diclorometano. Fonte: Gabriel Bolívar via Molview. Na primeira imagem, a fórmula estrutural do CH foi mostrada2Cl2, em que seus títulos covalentes C-H e C-Cl se destacam. Up e sua estrutura representada por um modelo de esferas e bares. Observe à primeira vista que as ligações C-H (esferas brancas) são curtas, enquanto as ligações C-Cl (esferas verdes) são longas.
Geometria de CHO2Cl2 É tetraédrico; mas distorcido por causa dos átomos de cloro mais volumosos. Uma extremidade do tetraedro é definida pelos dois átomos de cloro, mais eletronegativo que o hidrogênio e o carbono. Portanto, na molécula de CH2Cl2 Um momento dipolar permanente é estabelecido (1.6d).
Pode atendê -lo: reação de neutralizaçãoIsso permite que as moléculas de diclorometano interajam entre si através das forças dipolo-dipolo. Da mesma forma, essas interações intermoleculares são responsáveis por esse composto existir como um líquido, apesar de sua baixa massa molecular; Um líquido que, no entanto, é bastante volátil.
Propriedades
Aparência
Líquido incolor.
Massa molar
84,93 g/mol.
Cheiro
Doce, semelhante ao clorofórmio.
Limiar de cheiro
205 - 307 ppm.
Densidade
1.3266 g/cm3 (20 ºC).
Ponto de fusão
- 97,6 ºC.
Ponto de ebulição
39,6 ºC.
Solubilidade em água
25,6 g/L a 15 ºC e 5,2 g/L a 60 ºC.
O diclorometano é quase solúvel em água. Enquanto ambas as moléculas, Cho2Cl2 e h2Ou, eles são polares, suas interações são possivelmente ineficientes devido à repulsão entre átomos de cloro e oxigênio.
Solubilidade em outros solventes
Miscível com acetato de etila, álcool, hexano, benzeno, tetracloreto de carbono, éter de mergulho, clorofórmio e dimetilformamida.
Coeficiente de partição de octanol/água
Log p = 1,19.
Pressão de vapor
57,3 KPa (25 ºC). Esta pressão corresponde a aproximadamente 5,66 atm, refletindo alta pressão de vapor.
Densidade de vapor
2,93 no relacionamento aéreo tomado como 1.
Índice de refração (πd)
1.4244 (20 ºC).
Gosma
0,413 cp (25 ºC).
ponto de ignição
O diclorometano não é inflamável, mas quando misturado com o ar, forma vapores inflamáveis acima de 100 ºC.
Temperatura de auto -dirigir
556 ºC.
Estabilidade
É estável à temperatura ambiente na ausência de umidade, tendo uma estabilidade relativa quando comparada aos seus congêneres: clorofórmio de tetracloreto de carbono e tetracloreto.
Tende a carbonizar a altas temperaturas (300-450 ºC), quando seus vapores entram em contato com cloretos de aço e metal.
Decomposição
Pode ser dividido em contato com superfícies quentes ou uma chama, emitindo vapores tóxicos e irritantes de fosgen e cloreto de hidrogênio.
Pode atendê -lo: elétron diferencialCorrosão
O diclorometano ataca algumas formas de plásticos, borrachas e revestimentos.
Calor de vaporização
28,82 kJ/mol A 25 ºC.
Tensão superficial
28.20 Dynas/cm a 25 ºC.
Reatividade
O diclorometano reage fortemente com metais ativos, como potássio, sódio e lítio. Reage com bases fortes, por exemplo, potássio bouthexide. É incompatível com substâncias cáusticas, oxidantes e metais quimicamente ativos.
Além disso, ele reage com oxigênio líquido em ligas de sódio e potássio e tetróxido de nitrogênio. Em contato com a água, você pode executar alguns aços inoxidáveis, níquel, cobre e ferro.
Formulários
A maioria dos usos e aplicações do diclorometano é baseada em suas propriedades como solvente. Devido a essa característica, o diclorometano é usado em indústrias de alimentos, transporte, produção de medicina etc.
Processamento de comida
O diclorometano é usado nos grãos de café e folhas de chá descafeinados. Também é usado para extração de lúpulos para cerveja, bebidas e outras bandeiras alimentares, bem como para processamento de especiarias.
Indústria farmacêutica
O diclorometano é usado para a preparação de cefalosporina e ampicilina, além da fabricação de antibióticos, esteróides e vitaminas.
Fotografia
Também é usado como solvente na produção de triacetato de celulose (CTA), usado na criação de filmes de segurança.
Indústria eletrônica
É um composto ideal para a produção de placas de circuito impresso, usando a superfície de alumínio antes de adicionar a placa Photoret.
Tintas
O diclorometano é um solvente encontrado em vernizes e em separadores de tinta, usado para eliminar vernizes ou revestimento de pinturas de vários tipos de superfícies.
Transporte
Serve para degradar peças e superfícies metálicas presentes em equipamentos ferroviários, bem como em componentes de aeronaves.
Pode atendê -lo: água destiladaOutros usos
É usado como propulsor de spray (aerossóis) e como agente de expansão para espuma de poliuretano. Também é usado como fluido em alguns tipos de luzes de Natal.
Toxicidade
Efeitos agudos
A inalação de diclorometano pode causar irritação das vias aéreas superiores, tosse, chiado ou falta de ar.
Pode produzir vermelhidão da pele e, se o composto permanecer por muito tempo, causar queimaduras químicas. Em contato com os olhos, o diclorometano produz uma irritação grave que pode se estender a uma queimadura.
Além disso, atua como uma neurotoxina que gera alterações visuais, auditivas e psicomotoras; Mas esses efeitos são reversíveis para interromper a inalação do diclorometano.
Efeitos crônicos
O diclorometano pode afetar o sistema nervoso central e gerar dor de cabeça, confusão mental, náusea, vômito e perda de memória.
Nos animais, produz efeitos nocivos no fígado, rins, sistema nervoso central e sistema cardiovascular.
Assim que a carcinogênese não relataram um aumento significativo nas mortes por câncer em trabalhadores expostos ao diclorometano. No entanto, estudos em animais mostraram um aumento atribuível ao diclorometano na incidência de câncer de fígado e pulmões, bem como tumores benignos das glândulas mamárias.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ta Edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Centro Nacional de Informações sobre Biotecnologia. (2020). Diclorometano. Banco de dados PubChem., CID = 6344. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Diclorometano. Recuperado de: em.Wikipedia.org
- Brumer. (14 de julho de 2018). Diclorometano. Recuperado de: Brumer.com
- Msds online. (2019). Diclorometano (cloreto de metileno) Riscos e informações de segurança. Recuperado de: msdsonline.com
- EPA. (2000). Cloreto de metileno (diclorometano). [PDF]. Recuperado de: EPA.Gov
- « Determinação de métodos e exemplos de cinzas
- Tradições da cultura da Coréia do Sul, costumes, gastronomia, religião »

