Deutério
- 3256
- 566
- Terrell Stokes
Qual é o deutério?
Ele deutério É uma das espécies isotópicas de hidrogênio, que é representada como d ou 2H. Além disso, o nome de hidrogênio pesado foi dado, porque sua massa é duas vezes a do próton. Um isótopo é uma espécie que vem do mesmo elemento químico, mas cujo número de massa é diferente disso.
Esta distinção se deve à diferença no número de nêutrons que tem. O deutério é considerado um isótopo estável e pode ser encontrado em compostos formados pelo hidrogênio de origem natural, embora em uma proporção bastante pequena (menos de 0,02 %).
Dadas suas propriedades, muito semelhantes às do hidrogênio comum, ele pode substituir o hidrogênio em todas as reações em que participa, tornando -se substâncias equivalentes.
Por este e outras razões, esse isótopo tem muitas aplicações em diferentes áreas da ciência, tornando -se uma das mais importantes.
Estrutura de deutério
A estrutura do deutério é constituída principalmente por um núcleo que possui um próton e um nêutron, com um peso atômico ou massa de aproximadamente 2.014 g.
Da mesma forma, este isótopo deve sua descoberta a Harold C. Urey, um químico dos Estados Unidos, e seus colaboradores Ferdinand Brickwedde e George Murphy, em 1931.

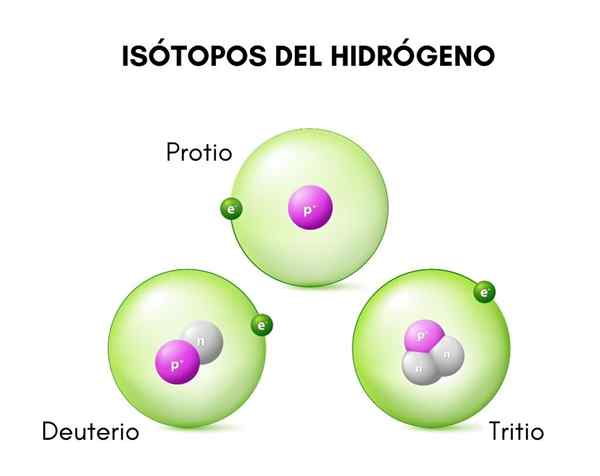
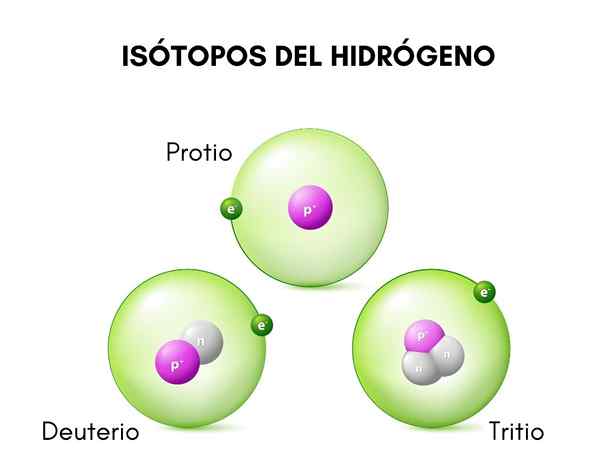
Na imagem superior, você pode ver a comparação entre as estruturas dos isótopos de hidrogênio, que existe na forma de Protio (seu isótopo mais abundante), deutério e trítio, ordenados da esquerda para a direita.
A preparação do deutério em seu estado puro foi realizada com sucesso pela primeira vez em 1933, mas desde a década de 1950 uma substância de fase sólida foi usada e que demonstrou estabilidade, chamada deuterida de lítio (LID), para substituir deutério e trítio em Um grande número de reações químicas.
Pode atendê -lo: óxido de cloro (iii): propriedades, estrutura, usosNesse sentido, a abundância desse isótopo foi estudada e foi observado que sua proporção na água pode variar um pouco, dependendo da fonte da qual a amostra é tomada.
Além disso, por meio de estudos de espectroscopia, a existência desse isótopo em outros planetas desta galáxia foi determinada.
Alguns dados sobre o deutério
A diferença fundamental entre os isótopos de hidrogênio (que são os únicos que foram nomeados de maneiras diferentes) está em sua estrutura, porque a quantidade de prótons e nêutrons de uma espécie conferir suas propriedades químicas.
Por outro lado, o deutério existente dentro dos corpos estelares é eliminado com uma velocidade mais rápida do que é originária.
Além disso, considera -se que outros fenômenos da natureza formam apenas uma quantidade muito pequena, de modo que sua produção continua a gerar interesse hoje.
Da mesma forma, uma série de investigações revelou que a grande maioria dos átomos que se formaram dessa espécie se originou no Big Bang; Esta é a razão pela qual sua presença em grandes planetas como Júpiter é avisada.
Como a maneira mais comum de alcançar essa espécie na natureza é quando é combinada com hidrogênio na forma de Protio, o interesse da comunidade científica ainda é despertada pelo relacionamento estabelecido entre a proporção de ambas as espécies em diferentes campos de ciências, como como como astronomia ou clima.
Pode atendê -lo: Renio: descoberta, propriedades, estrutura, usosPropriedades do Deutério
- É um isótopo sem características radioativas; isto é, é bastante estável de natureza.
- Pode ser usado para substituir o átomo de hidrogênio em reações químicas.
- Esta espécie manifesta um comportamento que não seja o hidrogênio comum em reações bioquímicas.
- Quando os dois átomos de hidrogênio são substituídos na água, D é obtido2Ou adquirir o nome de água pesada.
- O hidrogênio presente no oceano que está na forma de deutério existe em uma proporção de 0,016 % em relação ao protio.
- Nas estrelas, este isótopo tem uma tendência a se fundir rapidamente para dar origem ao hélio.
- D2Ou constitui uma espécie tóxica, embora suas propriedades químicas sejam muito semelhantes às de H2
- Quando os átomos de deutério são submetidos ao processo de fusão nuclear a altas temperaturas, o destacamento de grandes quantidades de energia é obtido.
- Propriedades físicas como ponto de ebulição, densidade, calor da vaporização, ponto triplo, entre outros, têm grandes magnitudes nas moléculas de deutério (D (D2) que em hidrogênio (h2).
- A maneira mais comum pela qual é encontrada está ligada a um átomo de hidrogênio, causando o deuterido de hidrogênio (HD).
Usa/aplicações
Devido às suas propriedades, o deutério é usado em uma ampla variedade de aplicações nas quais o hidrogênio está envolvido. Alguns desses usos são descritos abaixo:
- No campo da bioquímica, é usado na marcação isotópica, que consiste em "marcar" uma amostra com o isótopo selecionado para rastreá -lo através de sua passagem através de um determinado sistema.
Pode atendê -lo: ácido forte- Em reatores nucleares que realizam reações de fusão, é usado para reduzir a velocidade com que os nêutrons se movem sem a alta absorção deles que o hidrogênio comum apresenta.
- Na área de ressonância magnética nuclear (RMN), os solventes baseados no deutério são usados para obter amostras desse tipo de espectroscopia sem a presença de interferência produzida usando solventes hidrogenados.
- No campo da biologia, as macromoléculas são estudadas através de técnicas de dispersão de nêutrons, onde as amostras fornecidas com deutério são usadas para reduzir significativamente o ruído nessas propriedades de contraste.
- Na área da farmacologia, a substituição de hidrogênio é usada por deutério com o efeito isotópico cinético que é gerado e permite que esses medicamentos tenham uma meia -vida mais longa -vida.