Chrome (CR)

- 2814
- 857
- Lonnie MacGyver
 Chrome é um metal muito reativo. Wikimedia Commons
Chrome é um metal muito reativo. Wikimedia Commons O que é Chrome?
Ele cromada (CR) é um elemento químico do grupo 6 (VIB) da tabela periódica. Anualmente toneladas deste metal são produzidas pela extração de cromita ou mineral de magnésio (FECR2QUALQUER4, Mgcr2QUALQUER4), que são reduzidos com carvão para obter metal. É muito reativo e apenas em condições muito reduzidas, é em sua forma pura.
Seus minerais e óxidos, bem como uma pequena porção de cobre metálico, fazem esse elemento ocupar o número 22 dos mais abundantes do córtex da Terra.
A química do cromo é muito diversa porque pode formar links com quase toda a tabela periódica inteira. Cada um de seus compostos exibe cores que dependem do número de oxidação, bem como das espécies que interagem com ele.
Além disso, formam links para carbono, intervindo em um grande número de compostos organometais.
Características e propriedades do cromo
O cromo é um metal prateado em sua forma pura, com número atômico 24 e um peso molecular de aproximadamente 52 g/mol (52CR, seu isótopo mais estável).
Dados seus fortes elos de metal, apresenta pontos de fusão (1907 ºC) e ebulição (2671 ºC) de altura. Além disso, sua estrutura cristalina o torna um metal muito denso (7.19 g/ml).
Não reage com água para formar hidróxidos, mas com ácidos. Ele oxida com o oxigênio do ar geralmente produzindo óxido crômico, que é um pigmento verde amplamente usado.
Essas camadas de óxido criam o que é conhecido como Passivação, Proteger o metal contra corrosões subsequentes, uma vez que o oxigênio não pode penetrar no seio do metal.
Sua configuração eletrônica é [AR] 4S13d5, Com todos os elétrons ausentes e, portanto, exibe propriedades paramagnéticas. No entanto, o acasalamento de rotações eletrônicas pode ocorrer se o metal for submetido a baixas temperaturas, adquirindo outras propriedades, como antiferromagnetismo.
Pode atendê -lo: materiais refratáriosEstrutura química do cromo
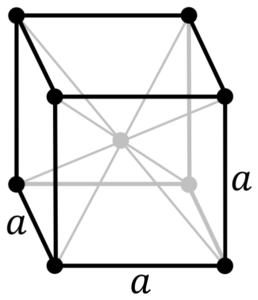 Estrutura de metal cromado. Fonte: por PNGs originais de Daniel Mayer, Drbob, Wikimedia Commons
Estrutura de metal cromado. Fonte: por PNGs originais de Daniel Mayer, Drbob, Wikimedia Commons Qual é a estrutura do metal cromado? Em sua forma pura, o cromo adota uma estrutura cristalina cúbica centrada no corpo (CC ou BCC). Isso significa que o átomo de cromo está localizado no centro de um cubo, cujas bordas são ocupadas por outros cromos (como na imagem superior).
Essa estrutura é responsável pelo cromo que possui altos pontos de fusão e ebulição, além de grande dureza. Os átomos de cobre se sobrepõem aos seus orbitais S e D para formar bandas de direção de acordo com a teoria da banda.
Assim, ambas as bandas estão cheias ao meio porque sua configuração eletrônica é [AR] 4S13d5, E como o orbital, pode abrigar dois elétrons e os orbitais de dez. Então, apenas metade das bandas formadas por suas sobreposições é ocupada por elétrons.
Com essas duas perspectivas -a estrutura cristalina e o vínculo metálico -muitos das propriedades físicas desse metal podem ser explicadas em teoria. No entanto, nenhum deles explica por que o Chrome pode ter vários estados ou números de oxidação.
Para isso, uma profunda compreensão da estabilidade do átomo em relação aos giros eletrônicos.
Número de oxidação do cromo
Porque a configuração eletrônica do Chrome é [AR] 4S13d5 Você pode ganhar até um ou dois elétrons (CR1- e cr2-), ou perdendo -os para adquirir diferentes números de oxidação.
Assim, se o cromo perder um elétron, seria como [AR] 4S03d5; Se você perder três, [AR] 4s03d3; E se você perder todos eles, [AR], ou o que é o mesmo, seria isoletrônico para o argônio.
Pode atendê -lo: ponto de ebulição: conceito, cálculo e exemplosO cromo não perde ou ganha elétrons devido a mero capricho: deve haver uma espécie que seja feita ou aceite para ir de um número de oxidação para outro.
O cromo possui os seguintes números de oxidação: -2, -1, 0, +1, +2, +3, +4, +5 e +6. Deles o +3, Cr3+, É o mais estável e, portanto, o predominante de todos; seguido por +6, cr6+.
Usos do Chrome
Como corante ou pigmento
O cromo possui uma ampla gama de aplicações, desde corante para diferentes tipos de tecidos, até o protetor que embeleza as peças de metal, no que é conhecido como cromado, que pode ser feito com metal puro ou com compostos CR (iii) ou CR (Vi).
Fluoruro Crômico (CRF3), por exemplo, é usado como corante para panos de lã; Sulfato Crômico (CR2(SW4)3), está destinado a colorir esmaltes, cerâmica, pinturas, tintas, vernizes e também serve a metais cromares; e óxido crômico (CR2QUALQUER3) Encontre também o uso onde sua atraente cor verde é necessária.
Portanto, qualquer mineral cromo com cores intensas pode ser destinado a tingir uma estrutura, mas depois disso, se esses compostos são perigosos ou não para o meio ambiente ou para a saúde dos indivíduos.
De fato, suas propriedades venenosas são usadas para economizar madeira e outras superfícies de ataque de insetos.
Em cromado ou metalurgia
Da mesma forma, pequenas quantidades de cromo ao aço são adicionadas para fortalecê -lo diante da oxidação e para melhorar seu brilho. Isso ocorre porque é capaz de formar carbonetos cinza (CR3C2) Muito resistente ao reagir com o oxigênio do ar.
Pode atendê -lo: hidróxido de cálcio (CA (OH) 2): estrutura, propriedades, obtenção, usoComo o Chrome pode polir até as superfícies brilhantes, o cromo apresenta desenhos de prata e cores como uma alternativa mais barata para esses fins.
Nutricional
Algum debate se o cromo pode ser considerado como um elemento essencial, ou seja, indispensável na dieta diária. Está presente em alguns alimentos em concentrações muito pequenas, como folhas verdes e tomates.
Também existem suplementos de proteína que regulam a atividade da insulina e favorecem o crescimento muscular, como é o caso do Chrome Polynicotinato.
Onde está o cromo?
O cromo é encontrado em uma grande variedade de minerais e gemas, como rubis e esmeraldas. O principal mineral do qual o cromo é extraído é o cromito (MCR2QUALQUER4), Onde M pode ser qualquer outro metal com o qual o óxido de cromo está associado. Essas minas abundam na África do Sul, na Índia, Turquia, Finlândia, Brasil e outros países.
Cada fonte tem uma ou mais variantes de cromita. Dessa forma, para cada m (fé, mg, mn, zn, etc.) Surge um mineral cromo diferente.
Para extrair o metal, é necessário. Isso é feito com carbono ou alumínio:
FECR2QUALQUER4 + 4c => Fe + 2Cr + 4Co
Da mesma forma, o Chromita é encontrado (pbcro4).
Geralmente, em qualquer mineral onde o íon Cr3+ pode substituir Al3+, Ambos com rádios iônicos ligeiramente semelhantes, constitui uma impureza que resulta em outra fonte natural deste metal incrível, mas prejudicial.
Referências
- Tenebaum e. Cromo. Retirado de: Química.Pomona.Edu
- Química Librettexts. Química do cromo. Tirado de: química.Librettexts.org
- Cromo. Retirado de: química explaada.com

