Mecanismos de corrosão galvânica, exemplos, proteção

- 3726
- 183
- Terrell Stokes
O Corrosão galvânica ou eletroquímica É um processo pelo qual um metal ou liga é degradado mais vertiginoso em comparação com sua oxidação convencional. Pode -se dizer que é uma oxidação acelerada e até intencionalmente liderada; Como em baterias ou baterias.
Isso ocorre sob uma série de condições. Primeiro, deve haver um metal ativo, chamado ânodo. Além disso, e em segundo lugar, deve haver um pouco de metal nobre reativo chamado cátodo. A terceira e quarta condições são a presença de um meio onde os elétrons são espalhados, como água e espécies iônicas ou eletrolíticas.
 Coroa de ferro oxidado. Fonte: Pixnio.
Coroa de ferro oxidado. Fonte: Pixnio. A corrosão galvânica é observável, especialmente em ambientes marinhos ou nas margens das praias. As correntes de ar levantam massas de vapor de água, que por sua vez arrastam alguns íons; O último acaba aderindo a uma fina camada de água ou gotas que repousam na superfície do metal.
Essas condições de umidade e salinidade favorecem a corrosão de metal. Isto é, uma coroa de ferro como a da imagem superior irá oxidar mais rapidamente se for exposto ao próximo do mar.
A facilidade que um metal terá que oxidar em comparação com outro pode ser medido quantitativamente através de seus potenciais de redução; Nos livros de química, existem tabelas abundantes com esses potenciais e. Quanto mais negativo, maior a sua inclinação para oxidar.
Além disso, se esse metal estiver na presença de outro com um potencial de redução muito positivo, portanto, tendo um grande ΔE, a oxidação do metal reativo será mais agressivo. Outros fatores, como pH, força iônica, umidade, presença de oxigênio e a relação entre as áreas do metal que é oxidada e a que é reduzida, também são importantes.
[TOC]
Mecanismos
Conceitos e reações
Antes de abordar os mecanismos por trás da corrosão galvânica, certos conceitos devem ser esclarecidos.
Em um rédox de reação, uma espécie perde elétrons (oxidada) enquanto outra os ganha (é reduzida). O eletrodo no qual a oxidação acontece é chamada ânodo; E em que a redução acontece, cátodo (em inglês a regra nemnestidade é geralmente usada Gato vermelho lembrar).
Assim, para um eletrodo (uma peça, parafuso, etc.) de um metal m, se isso for oxidado, diz -se que é o ânodo:
M => mn+ + ne-
O número de elétrons liberados será igual à magnitude da carga positiva de cátion mn+ resultante.
Em seguida, outro eletrodo ou metal (ambos os metais devem estar em contato de alguma forma), recebe os elétrons liberados; Mas isso não sofre uma reação química se eles ganharem elétrons, pois apenas os conduziria (corrente elétrica).
Portanto, deve haver outra espécie em solução que esses elétrons possam aceitar formalmente; como fáceis de reduzir os íons metálicos, por exemplo:
Pode atendê -lo: sistema não homogêneoRn+ + ne- => R
Ou seja, uma camada de metal r se formaria e o eletrodo se tornaria mais pesado; Enquanto o metal M perderia a massa porque seus átomos se dissolvem.
Despolarizadores
E se não houvesse cátions de metal que pudessem ser reduzidos o suficiente? Nesse caso, outras espécies presentes no meio levarão elétrons: despolarizadores. Estes estão intimamente relacionados ao pH: O2, H+, Oh- e h2QUALQUER.
Oxigênio e elétrons de ganho de água em uma reação expressa pela seguinte equação química:
QUALQUER2 + 2h2O + 4E- => 4OH-
Enquanto iones h+ Eles se transformam em H2:
2h+ + 2e- => H2
Isto é, oh espécie- e h2 São produtos comuns de corrosões galvânicas ou eletroquímicas.
Mesmo que o Metal R não participe de nenhuma reação, o fato de ser mais nobre que M promove sua oxidação; E, consequentemente, haverá uma maior produção de íons OH- o gás hidrogênio. Porque, afinal, é a diferença entre os potenciais de redução, ΔE, um dos principais motores desses processos.
Corrosão de ferro
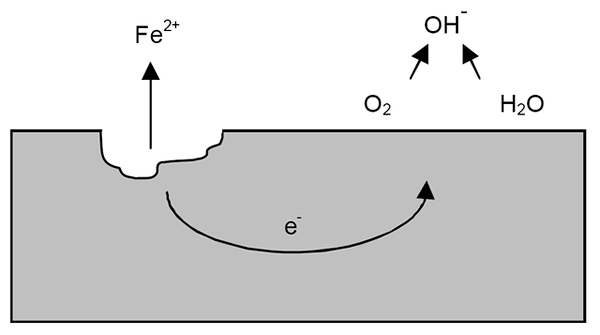 Mecanismo de corrosão para ferro. Fonte: Wikipedia.
Mecanismo de corrosão para ferro. Fonte: Wikipedia. Após os esclarecimentos anteriores, o exemplo de corrosão de ferro (imagem superior) pode ser abordada. Suponha que haja uma fina camada de água na qual o oxigênio se dissolve. Sem a presença de outros metais, serão os despolarizadores que marcarão as diretrizes de reação.
Assim, o ferro perderá alguns átomos em sua superfície para se dissolver na água como cátions fé2+:
Fe => fé2+ + 2e-
Os dois elétrons vão viajar pela peça de ferro por ser um bom condutor de eletricidade. Para que se saiba onde o oxidação ou o local anódico começou; Mas não onde a redução ou localização do local catódico continuará. O local catódico pode estar em qualquer lugar; E quanto maior sua área possível, pior será a corrosão do metal.
Suponha que os elétrons atinjam um ponto como mostrado na imagem superior. Lá, o oxigênio e a água sofrem a reação já descrita, pela qual OH é liberado-. Esses ânions oh- Eles podem reagir com fé2+ Para formar a fé (oh)2, que precipita e sofre oxidações subsequentes que finalmente o transformam em ferrugem.
Enquanto isso, o site anódico está rachando cada vez mais.
Exemplos
Na vida cotidiana, os exemplos de corrosões galvânicas são numerosas. Não precisamos nos referir à coroa de ferro: qualquer artefato feito de metais pode sofrer o mesmo processo na presença de ambientes úmidos e salinos.
Pode atendê -lo: grupo fosfatoAlém da praia, o inverno também pode contribuir com as condições ideais para a corrosão; Por exemplo, quando você joga sais na neve da estrada para impedir que os carros patinem.
Do ponto de vista físico, nos sindicatos soldados de dois metais, ele pode reter a umidade, sendo sites de corrosão ativos. Isso ocorre porque os dois metais se comportam como dois eletrodos, e o mais reativo perderá seus elétrons.
Se a produção de íons oh- É considerável, você pode até executar a tinta do carro ou o artefato em questão.
Índices anódicos
Pode -se construir seus próprios exemplos de corrosões galvânicas usando as tabelas em potencial de redução. No entanto, a tabela de índice anódico (simplificada por si só) será escolhida para ilustrar este ponto.
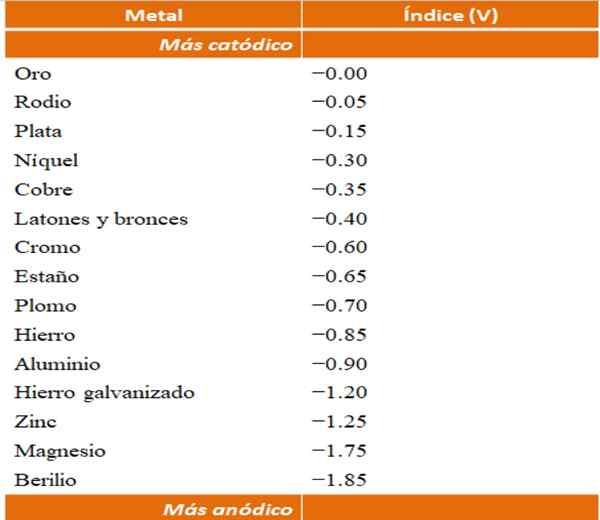 Índices anódicos para diferentes metais ou ligas. Fonte: Wikipedia.
Índices anódicos para diferentes metais ou ligas. Fonte: Wikipedia. Suponha, por exemplo, que gostaríamos de construir uma célula eletroquímica. Os metais que são a parte superior da tabela de índices anódicos são mais cátodo; isto é, eles são facilmente reduzidos e, portanto, será difícil tê -los em solução. Enquanto os metais que estão no fundo são mais anódicos ou reagentes, e facilmente corre.
Se escolhermos ouro e berílio, ambos os metais não poderiam ficar juntos por um longo tempo, uma vez que o berílio oxidaria com extremo rápido.
E se pelo contrário, tivermos uma solução de íons age+ E mergulhamos uma barra de alumínio, ela se dissolverá ao mesmo tempo que precipita partículas de prata de metal. Se esta barra se conectar a um eletrodo de grafite, os elétrons viajariam para ele eletroquimicamente depositar prata como um filme de prata.
E se, em vez da barra de alumínio, estivesse fora de cobre, a solução ficaria azulada pela presença dos íons Cu2+ na água.
Proteção contra corrosão eletroquímica
Revestimentos de sacrifício
Suponha que se destina a proteger uma lâmina de corrosão na presença de outros metais. A opção mais fácil seria adicionar magnésio, que cobriria o zinco para que, uma vez oxidado, os elétrons liberados do magnésio reduzam os cátions Zn2+ de volta.
No entanto, o filme da MGO sobre zinco mais cedo ou mais tarde acabaria rachando, fornecendo um local atual de alta densidade; isto é, a corrosão de zinco aceleraria acentuadamente nesses pontos.
Esta técnica de proteção contra a corrosão eletroquímica é conhecida como o uso do revestimento de sacrifício. O mais conhecido é o zinco, usado na famosa técnica chamada galvanização. Neles, o Metal M é coberto, especialmente ferro, zinco (Faith/Zn).
Pode atendê -lo: fenolftaleína (C20H14O4)Novamente, o zinco oxida e seu óxido serve para cobrir o ferro e transmitir elétrons que reduzem a fé2+ que pode ser formado.
Revestimentos nobres
Suponha novamente que você queira proteger a mesma folha de zinco, mas agora o cromo será usado em vez de magnésio. O cromo é mais nobre (mais catódico, veja a tabela de índices anódicos) do que o zinco, e é por isso que funciona como um revestimento nobre.
O problema desse tipo de revestimento é que, uma vez que rache, promoverá e acelerará ainda mais a oxidação do metal abaixo; Nesse caso, o zinco é corroído ainda mais do que ser coberto com magnésio.
E, finalmente, existem outros revestimentos que consistem em pinturas, plásticos, antioxidantes, gorduras, resinas, etc.
Experimento infantil
Placa de ferro em sais de cobre
Um experimento simples pode ser criado da mesma tabela de índices anódicos. Dissolvendo uma quantidade razoável (menos de 10 gramas) de Cuso4· 5h2Ou na água, é solicitado a uma criança que mergulhe em uma placa de ferro polida. Uma foto é tirada e o processo pode se desenvolver por algumas semanas.
A dissolução é inicialmente azulada, mas começará a perder a coloração enquanto a placa de ferro adquire uma cor de cobre. Isso ocorre porque o cobre é nobre que o ferro e, portanto, seus cátions Cu2+ Eles serão reduzidos a cobre metálico dos íons atribuídos pela oxidação do ferro:
Fe => fé2+ + 2e-
Cu2+ + 2e- => Cu
Limpeza de óxido de prata
Os objetos de prata se apagam ao longo do tempo, especialmente se eles estiverem em contato com uma fonte de compostos de enxofre. Seu óxido pode ser removido se o objeto estiver imerso em uma banheira de água com bicarbonato de sódio e papel alumínio. O bicarbonato fornece eletrólitos que facilitarão o transporte de elétrons entre o objeto e o alumínio.
Como resultado, a criança pode apreciar que o objeto perde seus pontos pretos e brilhará com sua cor prata característica; Enquanto a folha de alumínio será executada até desaparecer.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2019). Corrosão galvânica. Recuperado de: em.Wikipedia.org
- Stephen inferior. (16 de junho de 2019). Corrosão electocímica. Química Librettexts. Recuperado de: química.Librettexts.org
- A universidade aberta. (2018). 2.4 Processo de corrosão: corrosão galvânica. Recuperado de: aberto.Edu
- Customer Technical Service Brush Wellman Inc. (s.F.). Um guia para a corrosão galvânica. Materiais de engenharia de Wellman pincel.
- Giorgio carboni. (1998). Experimentos em electomontismo. Recuperado de: Fensci.com
- « Relativismo sofista Origem, características, exemplos
- Estrutura de hidrocarbonetos cíclicos, propriedades, exemplos »

