Estrutura de cloreto ferroso (FECL2), Usos, Propriedades

- 2537
- 64
- Melvin Mueller
Ele cloreto ferroso É um sólido inorgânico formado pela união de um cátion fé2+ e dois ânions cloreto cl-. Sua fórmula química é FECL2. Tende a absorver a água do meio ambiente. Um de seus hidratos é o fecl tetra -hidrato2 •4h2Ou que é um sólido esverdeado.
Destaque que é muito solúvel em água e tende a oxidar facilmente na presença de ar formando o cloreto de FECL férrico3. Por ser facilmente oxidável e, portanto, capaz de agir como redutor é amplamente utilizado em laboratórios de pesquisa química e biológica.
 FECL de cloreto de tetra -hidrato de Ferroso2 •4h2Ou sólido. Craven [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
FECL de cloreto de tetra -hidrato de Ferroso2 •4h2Ou sólido. Craven [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. O cloreto ferroso tem vários usos entre os quais ajudar outros agentes na oxidação do lodo derivado de águas residuais ou tratamento de esgoto. Também é usado no processo de revestimento de ferro metálico e tem alguns usos na indústria farmacêutica.
O uso da FECL também foi experimentado2 Na recuperação de metais valiosos dos catalisadores usados encontrados nos tubos de escape de veículos que trabalham com gasolina ou diesel.
É usado na indústria têxtil para consertar cores em alguns tipos de tecido.
[TOC]
Estrutura
O cloreto ferroso é formado por um íon da fé ferrosa2+ e dois íons cloreto cl- Unidos por meio de links iônicos.
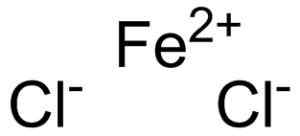 Ferroso Chloruro Fecl2 Onde estão os íons que compensam. EPOP [domínio público]. Fonte: Wikimedia Commons.
Ferroso Chloruro Fecl2 Onde estão os íons que compensam. EPOP [domínio público]. Fonte: Wikimedia Commons. A fé ferrosa2+ Tem a seguinte estrutura eletrônica:
1s2, 2s2 2 p6, 3s2 3p6 3d6, 4s0
onde você pode ver que perdeu dois elétrons da camada 4s.
Essa configuração não é muito estável e, por esse motivo, tende a oxidar, isto é, perder outro elétron, nesta época da camada 3D, formando o íon da fé3+.
Por sua parte, o cloreto de íons cl- Tem a seguinte estrutura eletrônica:
1s2, 2s2 2 p6, 3s2 3p6
onde você pode ver que adquiriu um elétron adicional na camada 3p, completando -o. Esta configuração é muito estável porque todas as camadas eletrônicas estão completas.
Nomenclatura
- Cloreto ferroso
- Cloreto de ferro (II)
Pode servir a você: Determinação de cinzas: métodos e exemplos- Dicloreto de ferro
- Cloreto ferroso tetra -hidrato: FECL2 •4h2QUALQUER
Propriedades
Estado físico
Colorido a verde pálido, cristais.
Peso molecular
126,75 g/mol
Ponto de fusão
674 ºC
Ponto de ebulição
1023 ºC
Peso específico
3,16 a 25 ºC/4 ºC
Solubilidade
Muito solúvel em água: 62,5 g/100 ml a 20 ºC. Solúvel em álcool, acetona. Ligeiramente solúvel em benzeno. Praticamente insolúvel em éter.
Outras propriedades
O FECL2 anidro é muito higroscópico. Absorva a água com facilidade do meio ambiente, formando uma variedade de hidratos, especialmente o tetra -hidrato, no qual para cada molécula FECL2 Existem 4 moléculas H2Ou vinculado a isso (FECL2 •4h2QUALQUER).
Na presença de ar, é lentamente oxidante para FECL3. Isso significa que o íon fé2+ Oxida facilmente a fé de íons3+.
Se você esquentar na presença de FECL de cloreto férrico rápido3 E óxido férrico Fe2QUALQUER3.
O FECL2 É corrosivo para metais e tecidos.
Obtenção
É obtido tratando um excesso de fé de ferro com solução aquosa de ácido clorídrico HCL a altas temperaturas.
Fé0 + 2 hcl → fecl2 + 2 h+
No entanto, devido à presença de água através desse método, o cloreto de tetra -hidrato ferroso é obtido2 •4h2QUALQUER.
Para obter anidro (sem água incorporada nos cristais), alguns pesquisadores optaram por realizar a reação do pó de ferro com as colinas anidro (sem água) no solvente tetra -hidrofurano (THF) a uma temperatura de 5 ° C.
O composto FECL é obtido dessa maneira2 •1.5thf, que quando aquecido a 80-85 ºC no vazio ou na atmosfera de nitrogênio (para evitar a presença de água) produz o FECL2 anidro.
Formulários
O cloreto ferroso tem vários usos com base em sua capacidade de redução, ou seja, pode ser facilmente oxidado. É usado, por exemplo, em pinturas e revestimentos, pois ajuda a corrigi -las da superfície.
O ferro é um micronutriente essencial para a saúde humana e alguns animais. Está envolvido na síntese de proteínas, respiração e multiplicação de células.
Portanto, o FECL2 É usado em preparações farmacêuticas. O íon fé2+ Como tal, é melhor absorvido do que o íon fé3+ No intestino.
Pode atendê -lo: carbonato de cálcio: estrutura, propriedades, formação, usosÉ usado para fabricação de FECL3. É usado em metalurgia, em revestimentos de ferro, para fornecer um depósito mais dúctil.
Aqui estão outros usos proeminentes.
Na coloração do tecido
O FECL2 É usado como um fixador mordente ou colorido em alguns tipos de tecido. O mordente reage quimicamente e se une simultaneamente ao corante e ao tecido que formam um composto insolúvel neste.
Dessa forma, o corante é fixado no tecido e sua cor se intensifica.
 FECL de cloreto ferroso2 Permite que as cores sejam corrigidas em tecidos. Gina Pina [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]. Fonte: Wikimedia Commons.
FECL de cloreto ferroso2 Permite que as cores sejam corrigidas em tecidos. Gina Pina [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]. Fonte: Wikimedia Commons. Em tratamento de águas residuais
O FECL2 É usado em plantas de tratamento de águas residuais ou resíduos (águas de esgoto).
Nesta aplicação, o cloreto ferroso participa da oxidação da lama, através de um processo chamado Oxidação de Fenton. Esta oxidação causa a ruptura das flocos de lama e permite a liberação de água que é fortemente ligada a isso.
 Seção de uma estação de tratamento de águas residuais onde você pode ver a lama. Às vezes, isso é tratado com cloreto de Ferroso FECL2 para que possa ser mais facilmente separado da água. Evelyn Simak/Sewage Works, ao norte de Dickleburgh. Fonte: Wikimedia Commons.
Seção de uma estação de tratamento de águas residuais onde você pode ver a lama. Às vezes, isso é tratado com cloreto de Ferroso FECL2 para que possa ser mais facilmente separado da água. Evelyn Simak/Sewage Works, ao norte de Dickleburgh. Fonte: Wikimedia Commons. Então a lama pode secar e descartar. O uso de cloreto ferroso ajuda a reduzir os custos do processo.
Também foi proposto recentemente para reduzir a formação de gás sulfeto ou sulfeto de hidrogênio nos referidos esgotos de esgotos.
Dessa maneira, a corrosão produzida por esse gás e os odores desagradáveis seriam reduzidos.
Em estudos químicos
Por suas propriedades redutoras (o oposto de oxidar) o FECL2 É amplamente utilizado em várias pesquisas em laboratórios de química, física e engenharia.
Certos cientistas usaram vapor de cloreto ferroso.
Esses catalisadores são usados para eliminar gases nocivos para o ser humano e o meio ambiente. Eles estão localizados no tubo de fuga de carros e caminhões que trabalham com gasolina ou diesel.
Pode atendê -lo: massa molar: como é calculado, exemplos e exercícios resolvidos Tubo de exaustão de um veículo onde é observado uma seção mais volumosa, é onde o catalisador está localizado para converter gases nocivos em gases amigáveis com o ambiente. Ahanix1989 na Wikipedia inglesa [domínio público]. Fonte: Wikimedia Commons.
Tubo de exaustão de um veículo onde é observado uma seção mais volumosa, é onde o catalisador está localizado para converter gases nocivos em gases amigáveis com o ambiente. Ahanix1989 na Wikipedia inglesa [domínio público]. Fonte: Wikimedia Commons. Depois de um certo tempo, o catalisador para o veículo é gasto e perde a eficácia e você deve substituí -lo. O catalisador gasto é descartado e os esforços estão sendo feitos para recuperar os metais valiosos que ele contém.
 Grade de cerâmica do catalisador onde os vestígios de metais valiosos para se recuperar com FECL estão localizados2. Reciclagem global-kat [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Grade de cerâmica do catalisador onde os vestígios de metais valiosos para se recuperar com FECL estão localizados2. Reciclagem global-kat [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Segundo os pesquisadores, com o ferro do cloreto ferroso, esses metais formaram ligas magnéticas.
As ligas podem ser extraídas com ímãs e depois recuperaram os metais valiosos por métodos já conhecidos.
Em estudos bioquímicos
Por possuir o cátion fé2+, que é um micronutriente importante no ser humano e em alguns animais, o FECL2 É usado em estudos de bioquímica e medicina.
Certos estudos permitiram demonstrar que o cloreto ferroso melhora a eficácia fungicida do plasma frio de argônio.
Plasma frio é uma tecnologia usada para a esterilização de superfícies médicas e instrumentos. É baseado na formação de radicais hidroxil · da umidade do meio ambiente. Esses radicais reagem com a parede celular do microorganismo e causam sua morte.
Nesta investigação, o FECL2 O efeito do plasma frio melhorou e acelerou a eliminação de um fungo resistente a outros métodos de desinfecção.
Alguns cientistas descobriram que o uso de FECL2 Permite aumentar o desempenho na obtenção de reações de glicose com base no bagaço de cana -de -açúcar.
Nesse caso, sendo fé2+ Um microement essencial para a saúde humana, sua presença em traços no produto não afetaria o ser humano.
Referências
- Fukuda, s. et al. (2019). Cloreto ferroso e sulfato ferroso melhoram a eficácia fúngicida do plasma frio de argônio atmosférico no aureobasidium pullulans melanizado. J Biosci Bioeng, 2019, 128 (1): 28-32. NCBI se recuperou.Clm.NIH.Gov.
- Ismal, ou.E. e yildirim, eu. (2019). Gags e biomordantes de metal. No impacto e perspectivas de química verde para tecnologia têxtil. Capítulo 3, pp.57-82. Recuperado de cientedirect.com.
- Zhang, w. et al. (2019). Co-catálise de cloreto de magnésio e cloreto ferroso para xilo-oligossacarídeos e produção de glicose a partir de bagaço de cana-de-açúcar. Biorresoral Technol 2019, 291: 121839. NCBI se recuperou.Nlm.NIH.Gov.
- Zhou, x. et al. (2015). Papel do ferro indígena na melhoria da desidratação do lodo nesta peroxidação. Relatórios Científicos 5: 7516. NCBI se recuperou.Nlm.NIH.Gov.
- Rathnayake, d. et al. (2019). Controle de sulfeto de hidrogênio nos esgotos catalisando a reação com oxigênio. Ciência do Ambiente Total 689 (2019) 1192-1200. NCBI se recuperou.Nlm.NIH.Gov.
- Taninouchi, e. e Okabe, T.H. (2018). Recuperação de metais do grupo de platina de catalisadores usados usando tratamento de vapor de cloreto de ferro. Metall e Materi Trans B (2018) 49: 1781. Link recuperado.Springer.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Cloreto ferroso. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Aresta, m. et al. (1977). Ferro (0) Oxidação por cloreto de hidrogênio em tetra -hidrofurano: maneira simples de ferro anidro (ii) cloreto. Química inorgânica, vol. 16, não. 7, 1977. Recuperado de bares.ACS.org.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- « História e significado da bandeira de Portugal (imagens revisadas)
- Origem da ética cristã, fundamentos, representantes »

