Propriedades de cloreto de manganês, estrutura, uso, riscos

- 3461
- 922
- Lonnie MacGyver
Ele cloreto de manganês É um sal inorgânico cuja fórmula química é MCL2. Consiste em íons Mn2+ e cl- em uma proporção de 1: 2; Para cada cátion MN2+ Há duas vezes nos ânions cl-.
Este sal pode formar vários hidratos: mnCl2· 2h2Ou (di -hidrato), MCL2· 4h2Ou (tetra -hidrato) e MCL2· 6h2Ou (hexa -hidrato) a forma mais comum de sal é tetra -hidratada.
 Cristais de cloreto de manganês rosa. Fonte: Ondřej Mangl [Domínio Público]
Cristais de cloreto de manganês rosa. Fonte: Ondřej Mangl [Domínio Público] As propriedades físicas do cloreto de manganês, como densidade, fusão e ponto de solubilidade na água, são influenciadas pelo seu grau de hidratação. Por exemplo, o ponto de fusão da forma de Anhydra é muito maior que o da forma tetra -hidratada.
A cor do cloreto de manganês é rosa pálido (imagem superior). A palidez é característica dos sais de metais de transição. O cloreto de manganês é um ácido fraco de Lewis.
O mineral conhecido como Escacquita é a forma anidro natural de cloreto de manganês (II); Como o Kempita.
O cloreto de manganês (II) é usado como agente de liga; Catalisador em reações de cloração, etc.
[TOC]
Propriedades físicas
Aspecto físico
- Formulário de Anhydra: Cristais cúbicos rosa.
- Formulário tetra -hidrato: Cristais monoclínicos avermelhados ligeiramente delicados.
Massas molares
- Anhidro: 125.838 g/mol.
- DIYDRARD: 161.874 g/mol.
- Tetra -hidrato: 197,91 g/mol.
Pontos de fusão
- Anhidro: 654 ºC.
- DIYDRARD: 135 ºC.
- Tetra -hidrato: 58 ºC.
Ponto de ebulição
Anhidra Form: 1.190 ºC.
Densidades
- Anidro: 2.977 g/cm3.
- DIYDRARD: 2,27 g/cm3.
- Tetra -hidrato: 2,01 g/cm3.
Solubilidade em água
Formulário de Anhydra: 63,4 g/100 ml a 0 ºC; 73,9 g/100 ml a 20 ºC; 88,5 g/100 ml a 40 ° C; e 123,8 g/100 ml a 100 ° C.
Solubilidade em solventes orgânicos
Solúvel em piridina e etanol, insolúvel em éter.
Decomposição
A menos que sejam tomadas precauções devidas, a desidratação de formas hidratadas em forma anidro pode causar desidratação hidrolítica, com a produção de cloreto de hidrogênio e oxicloreto de manganês.
ph
Uma solução de 0,2 m de cloreto de tetrahidrato de manganês em solução aquosa tem um pH de 5,5.
Pode atendê -lo: cromatogramaEstabilidade
É estável, mas sensível à umidade e incompatível com ácidos fortes, metais reativos e peróxido de hidrogênio.
Estrutura de cloreto de manganês
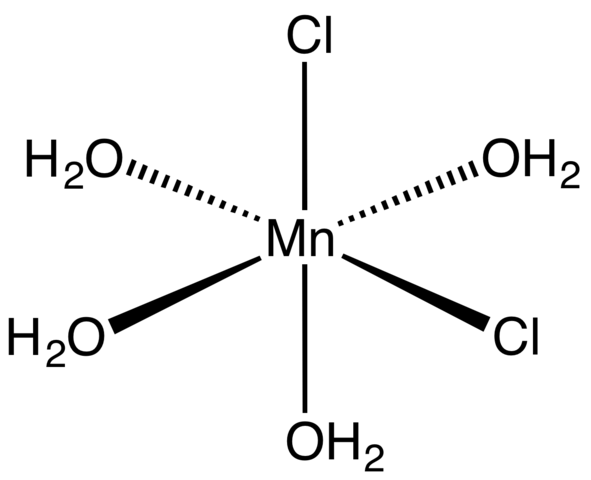 Complexo de coordenação para tetra -hidrato mnCl2. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Complexo de coordenação para tetra -hidrato mnCl2. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Começando com sal tetra -hidrato, cristais rosa e impressionantes, ele deve ser composto por complexos de coordenação (imagem superior). Neles, o Mn Metallic Center2+ é cercado por um octaedro definido por quatro moléculas H2Ou e dois ânions cl-.
Observe que os ligantes CL- Eles estão em posições cis; Todos são equivalentes na base retangular do octaedro, e não importa se o CL é "movido"- Para qualquer uma das outras três posições. Outro isômero possível para esta molécula coordenada está em que ambos Cl- Eles estão em posições trans; isto é, em extremidades diferentes (um acima e outro abaixo).
As quatro moléculas de água com suas pontes de hidrogênio permitem que dois ou mais octaedros se juntem por forças dipolo-dipolo. Essas pontes são altamente direcionais e adicionando as interações eletrostáticas entre o MN2+ e cl-, Eles estabelecem uma estrutura ordenada característica de um cristal.
A cor rosa do MNCL2· 4h2Ou é devido às transições eletrônicas do MN2+ e sua configuração D5. Da mesma forma, os distúrbios causados pela vizinhança das moléculas de água e os cloretos modificam a quantidade necessária de energia que esses elétrons devem absorver5 Para viajar níveis mais altos de energia.
Di -hidrato
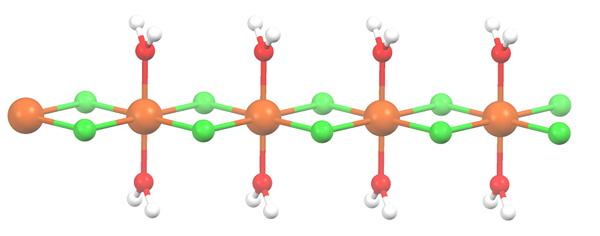 Estrutura polimérica para mnCl2 · 2H2O. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Estrutura polimérica para mnCl2 · 2H2O. Fonte: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] O sal foi desidratado e sua fórmula agora se torna MCL2· 2h2QUALQUER. O que acontece com o octaedro anterior? Nada, exceto que as duas moléculas H2Ou que eles abandonados são substituídos por dois cl-.
No começo, você pode dar a impressão errada de que existem quatro cl- para cada Mn2+; No entanto, metade do octaedro (axialmente) é na verdade a unidade repetitiva do vidro.
Assim, é verdade que existe um mn2+ coordenado em dois cl- e duas moléculas de água em posições trans. Mas para esta unidade interagir com outra, precisa de duas pontes CL, o que, por sua vez.
Pode atendê -lo: elementos diatômicosAlém das pontes de CL, as moléculas de água também colaboram com suas pontes de hidrogênio, para que essa cadeia de MNCL2· 2h2Ou não desarmar.
Anidro
Finalmente, o cloreto de magnésio terminou de perder toda a água contida em seus cristais; Você tem um sal de Anhydra agora, MCL2. Sem as moléculas de água, os cristais perdem significativamente a intensidade de suas cores rosa. O octaedro, como nos hidratos, permanece inalterado pela própria natureza manganês.
Sem moléculas de água, o MN2+ extremidades cercadas por um octaedro composto apenas por cl-. Este link de coordenação possui caráter covalente e iônico; Por esse motivo, geralmente se refere à estrutura do MNCL2 Como um cristal polimérico. Nele existem camadas alternativas de Mn e Cl.
Nomenclatura
Manganês tem muitos estados de oxidação possíveis. Por causa disso, a nomenclatura tradicional para o MNCL2 Não é esclarecido.
Por outro lado, o cloreto de manganês corresponde ao seu nome mais conhecido, ao qual careceria de adicionar o '(ii)' para que esteja de acordo com o estoque de nomenclatura: cloreto de manganês (ii). E Asçi, é a nomenclatura sistemática: dicloreto de manganês.
Formulários
Laboratório
O cloreto de manganês serve como um catalisador para a cloração de compostos orgânicos.
Indústria
O cloreto de manganês é usado como matéria -prima para a elaboração de anti -artisos para gasolina; material de soldagem para metais não ferrosos; intermediário na elaboração de pigmentos; E bebida a óleo de Linaza.
É usado na indústria têxtil para impressão e tingido; Na produção de vários sais de manganês, incluindo o tricarbonil de metilciclopentadienilmannganês usado como corante de tijolos; e na produção de baterias elétricas secas.
O cloreto de manganês é usado como agente de liga e é adicionado ao magnésio fundido para produzir ligas de manganês-nagnesio; como intermediário na preparação de agentes de secagem para pintura e verniz; e como um componente dos desinfetantes.
Pode atendê -lo: hidróxido de sódio (NaOH): estrutura, propriedades, usos, sínteseTambém é usado na purificação de magnésio.
Fertilizante e ração animal
O cloreto de manganês é usado como fonte de manganês, elemento, que, embora não seja um elemento nutricional primário para plantas como nitrogênio, fósforo e potássio, é usado em numerosas reações bioquímicas desses seres vivos desses seres vivos.
Também aumenta a alimentação de criação de animais para o suprimento de manganês, um oligo -oligo -oligo para o crescimento de animais.
O cloreto de manganês é um componente alimentar que fornece manganês, um elemento que intervém em vários processos necessários para a vida, incluindo: síntese de ácidos graxos e hormônios sexuais; assimilação da vitamina E; produção de cartilagem; etc.
Riscos
Pode produzir por contato com vermelhidão da pele, irritação e dermatite prolongada de exposição. O cloreto de manganês causa vermelhidão, dor e lágrima.
Por inalação a causa do sal, dor de garganta e falta de ar. Por outro lado, a ingestão pode ocorrer vômito, náusea e diarréia.
A inalação crônica excessiva desse sal pode levar a inflamação pulmonar e subsequente doença reativa das vias aéreas.
Sua ingestão excessiva pode causar transtornos mentais, desidratação, hipotensão, fígado e insuficiência renal, falha do sistema de vários órgãos e morte do sistema.
A neurotoxicidade é a manifestação inicial da ação indesejável do manganês, sendo capaz de apresentar dores de cabeça, tontura, perda de memória, hiperreflexia e tremor leve.
A toxicidade grave é manifestada por sintomas e sinais semelhantes aos observados na doença de Parkinson.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Manganês (II) Cloreto. Recuperado de: em.Wikipedia.org
- Nanomateriais da primavera do céu. (2016). Manganês Pó de cloreto. Recuperado de: ssnano.com
- Livro químico. (2017). Manganês de cloreto. Recuperado de: ChemicalBook.com
- Rede de dados de toxicologia. (s.F.). Manganês de cloreto. Toxnet. Recuperado de: toxnet.Nlm.NIH.Gov
- Gérard Cahiez. (2001). Manganês (II) Cloreto. doi.org/10.1002/047084289X.RM020
- Centro Nacional de Informações sobre Biotecnologia. (2019). Dicloreto de manganês. Banco de dados PubChem. CID = 24480. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- WebConsults Healthcare, S.PARA. (2019). Minerais: Manganês. Recuperado de: web consultas.com
- « Estrutura de cobalto, propriedades, aplicações
- Propriedades de cloreto de chumbo, estrutura, usa »

