Propriedades de cloreto de chumbo, estrutura, usa

- 3248
- 608
- Mr. Reginald Lindgren
Ele cloreto de chumbo É um sal inorgânico cuja fórmula química é PBCLn, Onde n é o número de oxidação do líder. Assim, quando o líder é como +2 ou +4, o sal é PBCL2 ou pbcl4, respectivamente. Portanto, existem dois tipos de cloretos para este metal.
Dos dois, o PBCL2 É o mais importante e estável; Enquanto o PBCL4 é instável e menos útil. O primeiro é de natureza iônica, onde o cátion PB2+ gera interações eletrostáticas com o clínico- construir uma rede cristalina; E o segundo, é covalente, com links PB-CL originando um chumbo e tetraedro de cloro.
 Agulhas PBCL2 precipitadas. Fonte: RRAUSCH1974 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Agulhas PBCL2 precipitadas. Fonte: RRAUSCH1974 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Outra diferença entre cloretos de chumbo é que PBCL2 É um sólido de cristais em forma de vidro branco (imagem superior); Enquanto o PBCL4 É um óleo amarelado que pode cristalizar a -15ºC. Entrada PBCL2 É mais estético do que o PBCL4.
Além do acima mencionado, o PBCL2 É encontrado na natureza como o mineral da cotunita; Enquanto o PBCL4 Não, já que é suscetível a decomposições. Enquanto de pbcl4 Você pode pegar o PBO2, do PBCL2 Eles derivam uma variedade infinita de compostos organometais.
[TOC]
Propriedades
As propriedades do cloreto de chumbo dependem da essência do número de oxidação do chumbo; Desde então, o cloro não muda, mas faz a maneira como interage com o chumbo. Portanto, ambos os compostos devem ser abordados; cloreto de chumbo (ii), por um lado, e o cloreto de chumbo (iv) no outro.
-Cloreto de chumbo (II)
Massa molar
278.10 g/mol.
Aparência física
Cristais de cor branca com formas de agulha.
Densidade
5,85 g/ml.
Ponto de fusão
501ºC.
Ponto de ebulição
950ºC.
Solubilidade em água
10,8 g/L a 20ºC. É pouco solúvel e a água deve ser aquecida para que uma quantidade considerável possa ser dissolvida.
Pode atendê -lo: hidróxido de níquel (ii): estrutura, propriedades, usos, riscosÍndice de refração
2.199.
Cloreto de chumbo (IV)
Massa molar
349.012 g/mol.
Aparência física
Líquido oleoso amarelado.
Densidade
3,2 g/ml.
Ponto de fusão
-15ºC.
Ponto de ebulição
50ºC. Em temperaturas mais altas, ele quebra o liberando cloro gasoso:
Pbcl4(S) => PBCL2(s) + cl2(g)
De fato, essa reação pode ser muito explosiva, então o PBCL é armazenado4 Em ácido sulfúrico a -80ºC.
Estrutura
-Cloreto de chumbo (II)
A princípio, foi mencionada que o PBCL2 É um composto iônico, portanto consiste em íons Pb2+ e cl- que constroem um cristal no qual uma razão Pb é estabelecida: Cl igual a 1: 2; Isto é, existem duas vezes também- Quais cátions pb2+.
O resultado é que são formados cristais ortorrômbicos cujos íons podem ser representados com um modelo de esferas e barras como na imagem inferior.
 Estrutura de cotunita. Fonte: Benjah-BMM27 [Domínio Público].
Estrutura de cotunita. Fonte: Benjah-BMM27 [Domínio Público]. Esta estrutura também corresponde à do mineral da cotunita. Embora as barras sejam usadas para indicar uma direcionalidade do link iônico, ela não deve ser confundida com um link covalente (ou pelo menos puramente covalente)).
Nos cristais ortorrômbicos, o PB2+ (Esferas Grillian) Possui nove cl- (esferas verdes) ao redor dele, como se ele estivesse trancado dentro de um prisma triangular. Para o intrincado da estrutura e a baixa densidade iônica do PB2+, As moléculas são difíceis de resolver o vidro; razão pela qual é pouco solúvel em água fria.
Molécula de fase gasosa
Quando nem o cristal nem o líquido podem resistir a altas temperaturas, os íons começam a vaporizar como moléculas de PBCL2 discreto; isto é, com ligações covalentes Cl-PB-C-CL e um ângulo de 98º, como se fosse um bumerangue. Dizem então que a fase gasosa consiste nessas moléculas de PBCL2 e não de íons transportados por correntes de ar.
Pode atendê -lo: eletronegatividadeCloreto de chumbo (IV)
Enquanto isso, o PBCL4 É um composto covalente. Porque? Porque o cátion PB4+ É menor e também tem uma maior densidade de carga de íons que o PB2+, que causa maior polarização da nuvem eletrônica do CL-. O resultado é que, em vez de uma interação do tipo iônico PB4+Cl-, O link covalente PB-C-CL é formado.
Considerando isso, a semelhança entre o PBCL é entendida4 E, por exemplo, o CCL4; Ambos são apresentados como moléculas individuais tetraédricas. Assim, é explicado por que esse cloreto de chumbo é um óleo amarelado em condições normais; Os átomos de Cl estão alguns relacionados entre si e "deslizam" quando duas moléculas de PBCL4 Eles estão indo.
No entanto, quando a temperatura desce e as moléculas se tornam mais lentas, a probabilidade e os efeitos dos dipolos instantâneos são aumentados (PBCL4 É apolar dada sua simetria); E então, o óleo congela como cristais hexagonais amarelos:
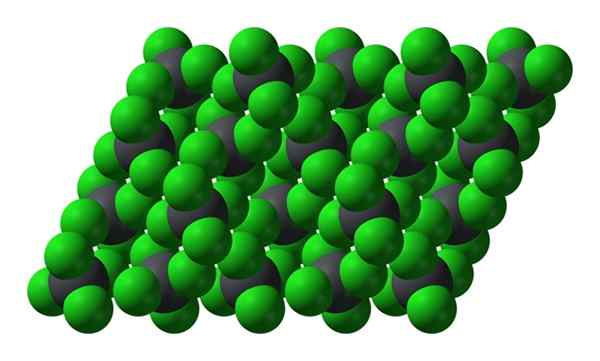 Estrutura cristalina de pbcl4. Fonte: Benjah-BMM27 [Domínio Público]
Estrutura cristalina de pbcl4. Fonte: Benjah-BMM27 [Domínio Público] Observe que cada esfera acinzentada é cercada por quatro esferas verdes. Essas moléculas de PBCL4 "Espremido" compõe um cristal instável e suscetível a decompor vigorosamente.
Nomenclatura
Os nomes: cloreto de chumbo (ii) e cloreto de chumbo (iv) correspondem aos designados de acordo com a nomenclatura de ações. Como o número de oxidação +2 é o menor para o chumbo e +4 o maior, ambos os cloretos podem ser nomeados de acordo com a nomenclatura tradicional como cloreto de plumbose (PBCL2) e cloreto plúbico (PBCL4), respectivamente.
E finalmente é a nomenclatura sistemática, que destaca o número de cada átomo do composto. Assim, o PBCL2 É dicloreto de chumbo e pbcl4 tetracloreto de chumbo.
Pode atendê -lo: impenetrabilidade químicaFormulários
Um uso prático para PBCL não é conhecido4 Além de servir a síntese de PBO2. No entanto, o PBCL2 É mais útil e é por isso que apenas alguns usos para esse cloreto de chumbo específico serão listados abaixo:
- Devido à sua natureza altamente luminescente, é destinado a detectores fotográficos, acústicos, ópticos e de radiação.
- Não absorvendo a região do espectro do infravermelho, é usado para a fabricação de vidro que transmitem esse tipo de radiação.
- Ele fez parte do que eles chamam de vidro Aureno, um material atraente de corações azuladas iridescentes usadas para fins ornamentais.
- Além disso, seguindo o tema da arte, quando você é alcançado, PBCL2· PB (OH)2 adquire tons esbranquiçados intensos, usando pigmento de chumbo branco. No entanto, seu uso foi desencorajado devido à sua alta toxicidade.
- Derretido e misturado com titanato de bário, Batio3, origina a cerâmica de titanato de bário e líder1 -xPBxTio3. Se um pb2+ Entre no Batio3, Um ba2+ Você deve deixar o vidro para permitir sua incorporação, e é dito que ocorre uma troca de cátions; É por isso que a composição do BA2+ É expresso como 1-x.
- E finalmente, do PBCL2 Vários compostos organometais da fórmula geral rumula são sintetizados r4Pb ou r3PB-PBR3.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). LEAD (II) Cloreto. Recuperado de: em.Wikipedia.org
- Formulação química. (2019). Cloreto de chumbo (IV). Recuperado de: formulação Quimica.com
- Clark Jim. (2015). Os cloretos de carbono, silício e chumbo. Recuperado de: Chemguide.co.Reino Unido
- Estudos não lineares espectrais e ópticos sobre cloreto de chumbo (PBCL2) Cristais. [PDF]. Recuperado de: Shodhganga.Infibnet.AC.em
- Centro Nacional de Informações sobre Biotecnologia. (2019). Cloreto de chumbo. Banco de dados PubChem; CID = 24459. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- « Propriedades de cloreto de manganês, estrutura, uso, riscos
- Custo de conversão como calculado e exemplos »

