Cloreto de lata (II)
- 2271
- 11
- Ernesto Bruen
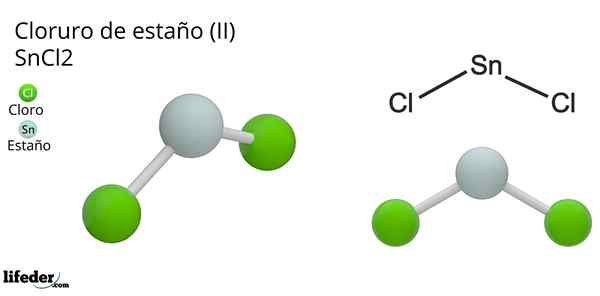
Ele Cloreto de lata (Ii) ou minúsculo cloreto, da fórmula química SNCl2, É um composto sólido branco e cristalino, produto da reação de estanho e uma solução de ácido clorídrico concentrado: SN (s) + 2HCl (conc) => SNC2(aq) + h2(g). O processo de sua síntese (preparação) consiste em adicionar peças de lata para reagir com ácido.
Depois de adicionar as peças de lata, a desidratação e a cristalização são realizadas até que o sal inorgânico seja obtido. Neste composto, o estanho perdeu dois elétrons de sua camada de valência para formar links com átomos de cloro.
Isso pode ser melhor compreendido se a configuração do Valencia for considerada (5s25 px2pe0pz0), dos quais o par de elétrons que ocupam o orbital px é atribuído aos prótons h+, Para formar uma molécula de hidrogênio diatômico. Isto é, esta é uma reação do tipo redox.
[TOC]
Propriedades de cloreto de lata
 Diidrato de cloreto de lata (II)
Diidrato de cloreto de lata (II) Links SNCl2 Eles são do tipo iônico ou covalente? As propriedades físicas do cloreto de estanho (ii) descartam a primeira opção. Os pontos de fusão e ebulição deste composto são 247 ºC e 623 ºC, indicativo de interações intermoleculares fracas, fato comum para compostos covalentes.
Seus cristais são brancos, o que se traduz em absorção zero no espectro visível.
Configuração do Valencia
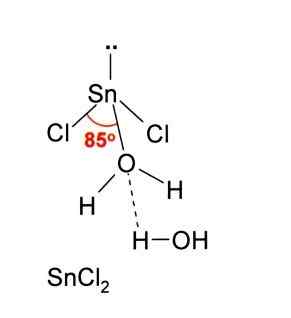
Na imagem acima, uma hortelã isolada de Snick é ilustrada2.
A geometria molecular deve ser plana porque a hibridação do átomo central é SP2 (3 orbitais SP2 e um orbital p puro para formar ligações covalentes), mas o torque livre de elétrons ocupa volume e empurra os átomos de cloro, dando à molécula uma geometria angular.
Na fase gasosa, este composto é isolado, por isso não interage com as outras moléculas.
Pode atendê -lo: SaponificaçãoComo perda do par de elétrons no orbital Px, TIN se transforma no íon Sn2+ e sua configuração eletrônica resultante é 5s25 px0pe0pz0, Com todos os seus orbitais disponíveis para aceitar links de outras espécies.
Íons cl- Eles coordenam com o íon Sn2+ Para dar origem ao cloreto de lata. A configuração eletrônica de lata neste sal é 5s25 px2pe2pz0, Ser capaz de aceitar outro par de elétrons em seu orbital gratuitoz.
Por exemplo, você pode aceitar outro ION CL-, formando o complexo de geometria plana trigonal (uma pirâmide de base triangular) e carregado negativamente [SNCl3]-.
Reatividade
O SNCl2 Possui alta reatividade e tendência para se comportar como ácido de Lewis (receptor de elétrons) para completar seu octeto de Valência.
Bem como aceitar um íon Cl-, O mesmo vale para a água, que "hidrata" o átomo de estanho quando uma molécula de água está ligada diretamente à lata, e uma segunda molécula de água forma interações por pontes de hidrogênio com o primeiro.
O resultado disso é que o SNCl2 Não é puro, mas coordenado com a água em seu sal di -hidratado: SNCl2· 2h2QUALQUER.
O SNCl2 É muito solúvel em solventes de água e polares, porque é um composto polar. No entanto, sua solubilidade na água, menor que seu peso em massa, ativa uma reação de hidrólise (ruptura de uma molécula de água) para gerar um sal básico e insolúvel:
SNCl2(aq) + h2Ou (l) sn (oh) cl (s) + hcl (aq)
A seta dupla indica que um saldo é estabelecido, favorecido à esquerda (em direção aos reagentes) se as concentrações de HCl aumentarem. Portanto, soluções SNCl2 Os funcionários têm um pH ácido, para evitar a precipitação do produto de sal indesejado de hidrólise.
Pode servir a você: nucleófilo: ataque nucleofílico, tipos, exemplos, nucleofilicidadeAtividade redutiva
Reage com o oxigênio do ar para formar cloreto de estanho (iv) ou cloreto é:
6 SNCl2(aq) + o2(g) + 2h2Ou (l) => 2SNCl4(aq) + 4sn (oh) cl (s)
Nesta reação, a lata oxida formando o link com o átomo de oxigênio eletronegativo e aumenta seu número de ligações com átomos de cloro.
Em geral, os átomos eletronegativos dos halogênios (F, Cl, Br e I) estabilizam os links dos compostos SN (IV) e esse fato explica por que o SNCl2 é um agente redutor.
Quando oxidado e perde todos os seus elétrons de valência, o íon Sn4+ é a configuração 5s05 px0pe0pz0, Sendo o par de elétrons no Orbital 5S, o mais difícil de ser "retirado".
Estrutura química de cloreto de lata
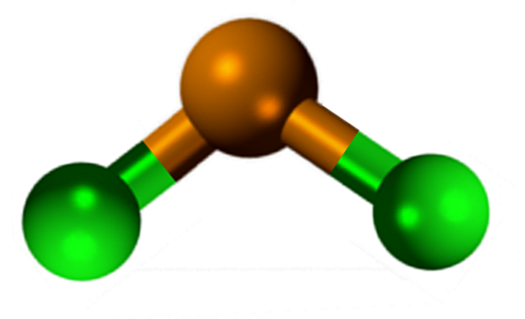 Estrutura de cloreto de lata (II)
Estrutura de cloreto de lata (II) O SNCl2 Apresenta uma estrutura cristalina do tipo ortorrômbico, semelhante às linhas serruchos, nas quais as pontas dos dentes são cloretos.
Cada linha é uma corrente SNCl3 formando uma ponte CL com outro átomo de SN (Cl-Sn (Cl)2-Cl- ···). Duas correntes, juntamente com interações fracas do tipo SN-Cl, constituem uma camada do arranjo, que se sobrepõe sobre outra camada e assim por diante até definir o sólido cristalino.
O par de elétrons gratuitos 5s2 Causar distorção na estrutura porque ocupa o volume (o volume da nuvem eletrônica).
O SN pode ter um número de coordenação igual a nove, o mesmo que ter nove vizinhos, desenhando um prisma trigonal com isso localizado no centro da figura geométrica e o CL nos vértices, além de outro CL localizado em cada um de os rostos quadrados do prisma.
Pode servir você: hidraceÉ mais fácil observar se for considerado uma corrente onde as SN (esferas cinza escuro) apontam, e os três Cl ligados a essa forma o piso triangular, enquanto os três clientes formam o teto triangular superior.
Usa/aplicações
Na síntese orgânica, é empregado como um agente redutor de compostos nitro aromáticos (ar-no2 À AR-NH2). Como sua estrutura química é laminar, encontra uso no mundo da catálise de reações orgânicas, além de ser um candidato em potencial para apoio catalítico.
Sua propriedade redutora é explorada para determinar a presença de compostos de ouro, para cobrir vidro com espelhos de prata e servir como antioxidante.
Além disso, em sua geometria molecular pirâmide trigonal (: snx3- M+) é usado como uma base de Lewis para a síntese de um vasto número de compostos (como o complexo de cluster de PT3Sn8Clvinte, onde o par livre de elétrons é coordenado com um ácido de Lewis).
Riscos
O SNCl2 Você pode danificar células de sangue branco. É corrosivo, irritante, carcinogênico e tem altos impactos negativos nas espécies que habitam os ecossistemas marinhos.
Pode se decompor em altas temperaturas, liberando o gás de cloro prejudicial. Em contato com agentes muito oxidantes, desencadeia reações explosivas.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. Em Os elementos do grupo 14 (quarta edição., p. 329). Mc Graw Hill.
- ChemicalBook. (2017). ChemicalBook: ChemicalBook.com
- PubChem. (2018). Cloreto de lata. PubChem recuperado: PubChem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2017). TIN (II) Cloreto. Wikipedia se recuperou: em.Wikipedia.org
- F. Hulliger. (1976). Química estrutural das fases do tipo camada. P-120,121. D. Reidel Publishing Company.

