Cloreto de cobre (i) (CUCL) Estrutura, propriedades, usos
- 3475
- 132
- Mr. Reginald Lindgren
Ele Cloreto de cobre (i) É um composto inorgânico formado por cobre (Cu) e cloro (CL). Sua fórmula química é CUCL. O cobre neste composto tem Valência de +1 e o cloro -1. É um sólido cristalino branco que, quando exposto por muito tempo no ar, adquire uma coloração esverdeada devido à oxidação do cobre (i) em cobre (ii).
Ele se comporta como ácido de Lewis que precisa de elétrons de outros compostos que são bases de Lewis, com as quais formam adutos complexos ou estáveis. Um desses compostos é o monóxido de carbono (CO); portanto, a capacidade de se unir entre eles é usada industrialmente para extrair o CO dos refrigerantes.
 Cloreto de cobre (i) (CUCL) purificado. LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons.
Cloreto de cobre (i) (CUCL) purificado. LEIEM/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0). Fonte: Wikimedia Commons. Possui propriedades ópticas que podem ser usadas em semicondutores emissores de luz. Além disso, os nanocubos CUCL têm um grande potencial para serem usados em dispositivos de energia eficientes.
É usado na arte da pirotecnia porque em contato com uma chama produz uma luz verde azulada.
[TOC]
Estrutura
O CUCL é formado pelo íon da copa do CUPROSO+ e cloreto de ânion cl-. A configuração eletrônica do íon cu+ é:
1s2 2s2 2 p6 3s2 3p6 3d10 4s0
E é porque o cobre perdeu o elétron da camada 4s. O íon cloreto tem a configuração:
1s2 2s2 2 p6 3s2 3p6
Pode -se observar que ambos os íons têm suas camadas eletrônicas completas.
Este composto cristaliza com simetria cúbica. Na imagem abaixo, é observado o arranjo dos átomos em uma unidade cristalina. Esferas rosa correspondem a esferas de cobre e verde ao cloro.
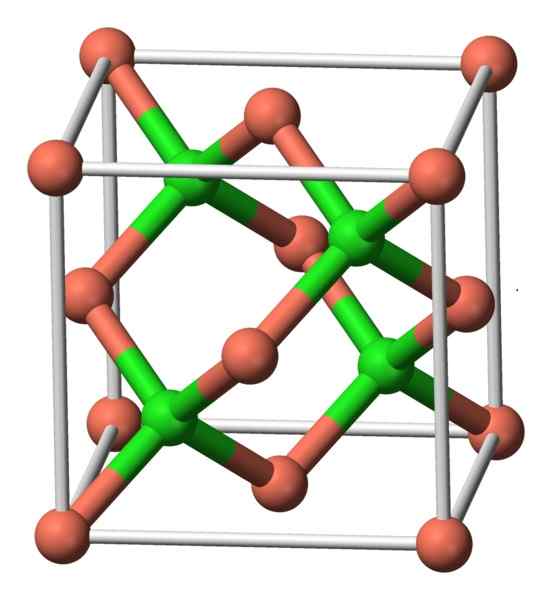 Estrutura CUCL. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura CUCL. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Cloreto de cobre (i)
- Cloreto de cuprove
- Monoclorado de cobre
Propriedades
Estado físico
O sólido branco cristalino que no ar prolongado com o ar é oxidado e fica verde.
Peso molecular
98,99 g/mol
Ponto de fusão
430 ºC
Ponto de ebulição
Aproximadamente 1400 ºC.
Densidade
4.137 g/cm3
Solubilidade
Quase insolúvel em água: 0,0047 g/100 g de água a 20 ° C. Insolúvel em etanol (C2H5Oh) e acetona (escolha3(C = o) CH3).
Pode atendê -lo: Alilo: unidade allyic, carbocalização, radical, exemplosPropriedades quimicas
É instável no ar porque Cu+ tende a oxidar CU2+. Com o tempo, óxido cúprico (CuO), hidróxido cuposo (CuOH) ou um oxicloreto complexo e sal é girado verde.
 Cloreto de cobre (i) que foi exposto ao meio ambiente e parcialmente oxidado. Cuoh, Cuoh e outros compostos podem conter. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons.
Cloreto de cobre (i) que foi exposto ao meio ambiente e parcialmente oxidado. Cuoh, Cuoh e outros compostos podem conter. Benjah-BMM27 / Domínio Público. Fonte: Wikimedia Commons. Em solução aquosa, também é instável porque uma reação de oxidação e redução ocorre simultaneamente, formando Íons metálicos de cobre e cobre (II):
CUCL → Cu0 + CUCL2
O CUCL como ácido Lewis
Este composto atua quimicamente como o ácido de Lewis, o que significa que está ansioso para os elétrons, por isso forma adutos estáveis com compostos que podem fornecê -los.
É muito solúvel em ácido clorídrico (HCl), onde os íons cl- Eles se comportam como doadores de elétrons e espécies como CUCL são formados2-, CUCL32- e cu2Cl42-, entre outras.
 Esta é uma das espécies que são formadas nas soluções CUCL em HCl. Autor: Marilú Stea.
Esta é uma das espécies que são formadas nas soluções CUCL em HCl. Autor: Marilú Stea. As soluções aquosas da CUCL têm a capacidade de absorver o monóxido de carbono (CO). Essa absorção pode ocorrer quando essas soluções são ácidas e neutras ou com amônia (NH3).
Em tais soluções, estima -se que várias espécies como Cu (CO) sejam formadas+, Cuco)3+, Cuco)4+, CUCL (CO) e [Cu (CO) CL2]-, que depende do meio.
Outras propriedades
Possui características eletrooptas, baixa perda óptica em uma ampla gama de espectro de luz, do visível a infravermelho, baixo índice de refração e baixo constante.
Obtenção
O cloreto de cobre (i) pode ser obtido reagindo o cobre de metal diretamente com gás de cloro a uma temperatura de 450-900 ° C. Esta reação se aplica industrialmente.
2 Cu + Cl2 → 2 CUCL
Você também pode usar um composto redutor, como ácido ascórbico ou dióxido de enxofre, para passar o cloreto de cobre (II) para o cloreto de cobre (i). Por exemplo, no caso do SO2, Isso é oxidado em ácido sulfúrico.
2 CUCL2 + SW2 + 2 h2O → 2 CUCL + H2SW4 + 2 hcl
Formulários
Em processos de recoveria
A capacidade das soluções absorventes e insorberas.
Pode atendê -lo: turbidimetriaPor exemplo, o processo chamado Cosorb usa cloreto de cobre estabilizado na forma de um sal complexo com alumínio (Anycl4), que se dissolve em um solvente aromático como o tolueno.
A solução absorve o CO de uma corrente gasosa para separá -la de outros gases, como CO2, N2 e cap4. Então a solução rica no monóxido é aquecida sob pressão reduzida (ou seja, menor que a atmosférica) e o CO é exorg. O gás recuperado dessa maneira é de alta pureza.
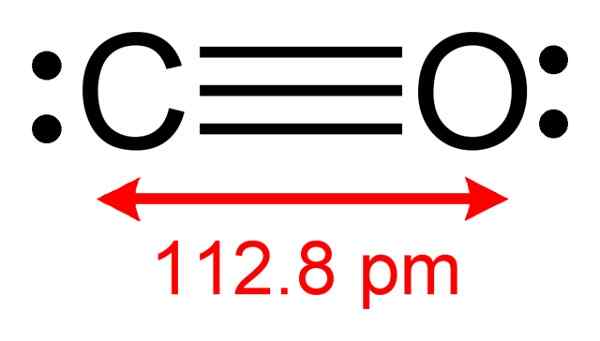 Estrutura de monóxido de carbono onde os elétrons disponíveis para formar complexos com o CUCL são observados. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura de monóxido de carbono onde os elétrons disponíveis para formar complexos com o CUCL são observados. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Este processo permite que você obtenha um CO puro.
Na catálise
O CUCL é usado como catalisador para várias reações químicas.
Por exemplo, a reação do elemento Germanio (GE) com cloreto de hidrogênio (HCl) e etileno (CH2= Cap2) pode ser feito usando este composto. Também serve para a síntese de compostos de silício orgânico e derivados orgânicos heterocíclicos variados de enxofre e nitrogênio.
Você pode sintetizar um polímero polifenileneter usando um 4-amipirina e um sistema catalítico de agachamento. Este polímero é muito útil para suas propriedades mecânicas, pouca absorção de umidade, excelente isolamento de eletricidade e resistência ao fogo.
Na obtenção de compostos orgânicos de cobre
Os compostos alkenilcupratato podem ser preparados reagindo em um terminal alquiado.
Na obtenção de polímeros unidos para metais
O cloreto de cobre (i) pode ser coordenado com polímeros que formam moléculas complexas que servem como catalisadores e que combinam a simplicidade de um catalisador heterogêneo com a regularidade de um homogêneo.
Em semicondutores
Este composto é usado na obtenção de um material formado por γ-corpu no silício.
Esses materiais têm amplo uso em diodos emissores de luz ultravioleta, diodos a laser e detectores de luz.
Pode servir a você: brometo de potássio (KBR): estrutura, propriedades, usosEm Super CardPisors
Este produto obtido na forma de nanopartículas cúbicas ou de nanocubos permite fabricar supercaders, pois possui uma excelente velocidade de carga, alta reversibilidade e pequena perda de capacitância.
Os supercorders são dispositivos para armazenar energia que se destaca por sua alta densidade de potência, operação na operação, ciclos de carregamento e descarga rápido, estabilidade a longo prazo e são ecológicos.
 Nanocubos CUCL pode ser usado em aplicações eletrônicas e de armazenamento de energia. Autor: Tide Ele. Fonte: Pixabay.
Nanocubos CUCL pode ser usado em aplicações eletrônicas e de armazenamento de energia. Autor: Tide Ele. Fonte: Pixabay. Outros aplicativos
Dar.
 A cor verde de alguns fogos de artifício pode ser devida à ronco. Autor: Hans Braxmeier. Fonte: Pixabay.
A cor verde de alguns fogos de artifício pode ser devida à ronco. Autor: Hans Braxmeier. Fonte: Pixabay. Referências
- Milek, J.T. e Neuberger, M. (1972). Cloreto cupro. In: Materiais Modulares Eletroopticos Lineares. Springer, Boston, MA. Link recuperado.Springer.com.
- Chumbo, d.R. (Editor) (2003). Manual de Química e Física do CRC. 85º CRC Press.
- Sneeden, r.P.PARA. (1982). Métodos de absorção/dessorção. Em química organometálica abrangente. Volume 8. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Chandrashekhar, v.C. et al. (2018). Avanços recentes na síntese direta de compostos organometálicos e de coordenação. Na síntese direta de complexos metálicos. Recuperado de cientedirect.com.
- Kyushin, s. (2016). Síntese de Organossilicon para Construção de Clusters de Organosilício. Em métodos eficientes para preparar compostos de silício. Recuperado de cientedirect.com.
- Van Koten, G. e Noltes, J.G. (1982). Compostos organocoppers. Em química organometálica abrangente. Volume 2. Recuperado de cientedirect.com.
- Danieluk, d. et al. (2009). Propriedades ópticas de filmes CUCL dopados de oxigênio e oxigênio na sublata de silício. J Mater Sci: Mater Electron (2009) 20: 76-80. Link recuperado.Springer.com.
- Yin, b. et al. (2014). Nanocubos de cloreto cupros cultivados em falhas de cobre para eletrodos de pseudocapacitor. Nano-Micro Lett. 6, 340-346 (2014). Link recuperado.Springer.com.
- Kim, k. et al. (2018). Um ligante/cobre de amina aromático altamente eficiente (i) cloreto. Polímeros 2018, 10, 350. MDPI se recuperou.com.
- Wikipedia (2020). Cobre (i) cloreto. Recuperado de.Wikipedia.org.
- « Fração molar como é calculada, exemplos, exercícios
- Obtenção de gordura butírica, tipos, composição, usos, benefícios »

