Cloreto de alumínio (ALCL3)

- 4747
- 957
- Tim Mann
 Fórmula e estrutura de cloreto de alumínio
Fórmula e estrutura de cloreto de alumínio O que é cloreto de alumínio?
Ele Cloreto de alumínio É um composto químico inorgânico cuja fórmula é Alcl3. É apresentado como uma poeira sólida ou branca, embora devido a uma contaminação com cloreto férrico e umidade, possa se tornar amarelo. Consiste em um ácido de Lewis, mas em certas circunstâncias também se comporta como uma base de Lewis.
Apesar do alumínio como metal na tabela periódica, há uma ligação covalente entre alumínio e cloro para formar cloreto de alumínio.
Essa ligação covalente poderia explicar por que o cloreto de alumínio fundido é um mau condutor de eletricidade; Enquanto os sais fundidos de outros compostos, como o cloreto de sódio, são bons condutores de eletricidade.
O cloreto de alumínio é produzido por uma reação exotérmica entre alumínio e cloro, ou cloreto de hidrogênio, a uma temperatura entre 650 e 750 ºC.
O cloreto de alumínio é usado como um antitranspirante e para combater a transpiração excessiva. Um de seus derivados é usado como agente coagulante no tratamento de águas residuais industriais e também é usado como o principal catalisador nas reações químicas da indústria.
Estrutura de cloreto de alumínio
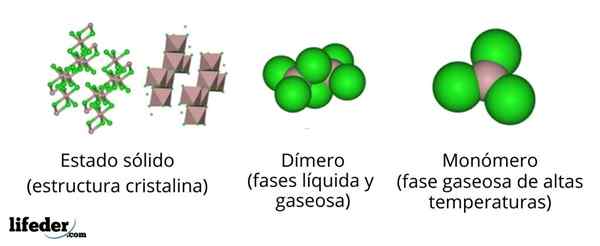
Na imagem superior, temos representações diferentes para cada uma das estruturas cristalinas ou moleculares que exibem o cloreto de alumínio anidro, Alcl3, Em vários de seus estados físicos.
O alcl3 O sólido consiste em uma estrutura cristalina monoclínica formada por camadas de octaedros coordenadas entre si. Nestes octaedros (cor marrom), o íon para3+ É coordenado com seis íons cl-, Cloretos em ação como pontes entre dois octaedros.
Quando a temperatura aumenta e o AllL é fundado3, As camadas são separadas em unidades para o2Cl6 (Centro de Imagem). Agora, o átomo de alumínio forma ligações com três átomos de cloro e um link com o outro átomo de alumínio: Cl3Al-alcl3. Esses dímeros explicam por que o Alcl3 fundido é menos denso que seus cristais.
Pode atendê -lo: gadolinio: estrutura, propriedades, obtenção, usosNa fase de vapor, os dímeros para o2Cl6 Eles se distanciam. Mas se esse vapor for submetido a altas temperaturas, o dímero se dissocia em unidades moleculares alcl3, em que o átomo de alumínio forma três ligações com átomos de cloro. O alcl3 apresenta uma geometria plana trigonal.
Propriedades de cloreto de alumínio
 Amostra sólida de cloreto de alumínio com tons amarelados. Fonte: Xlolitox, CC por 3.0, via Wikimedia Commons
Amostra sólida de cloreto de alumínio com tons amarelados. Fonte: Xlolitox, CC por 3.0, via Wikimedia Commons Fórmulas
Alcl3 (anidro)
Alcl3· 6h2O (hexa -hidrato)
Massa molar
133.34 g/mol (Anhydro)
241.43 g/mol (hexa -hidrato)
Aparência física
Poeira sólida ou branca cristalina. Pode se tornar um tom amarelado devido à contaminação com cloreto férrico. Você também pode mudar para uma cor acinzentada para umidade.
Ponto de fusão
192.4 ºC
Ponto de ebulição
Sublima a 178 ºC, portanto não é fácil obter o ponto de ebulição do cloreto de alumínio.
Densidade
2.48 g/cm3 (anidro)
2.398 g/cm3 (Hexa -hidrato)
Solubilidade em água
439 g/l a 0 ºC
458 g/L a 20 ºC
466 g/l a 30 ºC
O cloreto de alumínio é um composto higroscópico que pode absorver a água do ar úmida, emitindo uma fumaça durante o processo.
Solubilidade em outros solventes
Etanol solúvel, clorofórmio, tetracloreto de carbono, benzofenona e nitrobenzeno. Ligeiramente solúvel em benzeno.
Pressão de vapor
13.3 kPa a 151 ºC (0.131 atm).
Gosma
0.35 cp a 197 ºC
Reatividade
O cloreto de alumínio é uma substância anfotato, ou seja, se comporta como um ácido ou uma base. No entanto, sua ação como ácido é preponderante, pois o cloreto de alumínio é usado como ácido de Lewis e, ao mesmo tempo, é um catalisador em muitas reações químicas; Entre eles, a reação de Friedel-Crafts.
Pode atendê -lo: neodímio: estrutura, propriedades, usosAté o cloreto de alumínio é classificado como um ácido, em vez de fazê -lo como um sal.
O cloreto de alumínio anidro em solução aquosa é transformada em sal hexa -hidrato (ALCL3· 6h2O), que não retorna à forma anidro, aquecendo.
Átomos de alumínio de duas moléculas de ALCL3 Eles interagem entre si para completar 8 elétrons em sua camada de valência, o que resulta na formação do dímero para o2Cl6. Este dímero está presente em cloreto de alumínio fundido e vapor.
O cloreto de alumínio reage com hidróxido de sódio para formar hidróxido de alumínio, um precipitado gelatinoso:
Alcl3 + Naoh → Al (OH)3 + 3 NACL
Aplicações de cloreto de alumínio
Antitranspirante e anti -hemorrágico
 O cloreto de alumínio faz parte dos ingredientes usados nas formulações de vários desodorantes. Fonte: Th145, CC BY-SA 2.0, via Wikimedia Commons
O cloreto de alumínio faz parte dos ingredientes usados nas formulações de vários desodorantes. Fonte: Th145, CC BY-SA 2.0, via Wikimedia Commons O cloreto de alumínio é usado como um antitranspirante em desodorantes pessoais e também é usado para controlar a transpiração excessiva (hiperidrose). Também é usado em formulações para controlar pequenos sangramentos, como os apresentados em tratamentos dentários.
Tratamento de águas residuais
O cloreto de alumínio na forma de PAC (cloreto de polyalumin) é usado como coagulante no tratamento de águas residuais industriais, devido à sua capacidade de esclarecer a água e o lodo de desidrato.
Catalisador
O cloreto de alumínio é um dos principais catalisadores usados na indústria, atuando como um catalisador em inúmeras reações, incluindo Friedel-Crafts.
Pode atendê -lo: Europium: estrutura, propriedades, obtenção, usosO cloreto de alumínio catalisa as reações de preparação das antraquinonas, algumas das quais são usadas na indústria têxtil. Existem também antraquinonas que possuem propriedades antibacterianas, antiparasitárias, fungicidas e antivirais.
O cloreto de alumínio catalisa as reações produzidas por dodecilbenzeno, usadas na produção de detergentes e etilbenzeno, composto usado na fabricação de poliestireno, polímero usado na elaboração de plásticos, resinas e borracha.
O cloreto de alumínio também é usado como catalisador em uma reação que faz parte da produção de gasolina de alta octanagem. Da mesma forma, catalisa o processo de rachadura de óleo.
Riscos
O cloreto de alumínio é uma substância corrosiva e seu contato pode causar irritação e lesões na pele e ocular, produzindo danos oculares.
Ao se dissolver na água, os gases venenosos podem ser liberados, como o cloreto de hidrogênio; gases capazes de inalar uma irritação do nariz e da garganta, sendo capaz de causar irritação resistente e pulmonar. Essa irritação pode levar ao acúmulo de fluido nos pulmões (edema pulmonar), que termina em uma emergência médica.
Ele tentou estabelecer uma conexão entre a doença de Alzheimer e o cloreto de alumínio; Embora os resultados da pesquisa não sejam conclusivos.
Da mesma forma, a conexão entre o uso de desodorantes que eles usam como antiantranspirante ao Alll foi investigado3 e câncer de mama. A pesquisa não foi capaz de demonstrar um relacionamento conclusivo. De qualquer forma, o cloreto de alumínio bloqueia a operação de um sistema natural de desintoxicação do organismo e emissão de calor, como suor.
Referências
- Wikipedia. (2021). Alumínio de cloreto. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia (2021). Alumínio de cloreto, resumo do composto PubChem para CID 24012. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- NJ Health. (2008). Folha de fato da substância perigosa: cloreto de alumínio. [PDF]. Recuperado de: NJ.Gov
- Enciclopédia Britannica. (2021). Alumínio de cloreto. Recuperado de: Britannica.com
- Elsevier b.V. (2021). Antraquinonas. Cientedirect. Recuperado de: ScientEdirect.com
- John p. Cunha. (02 de maio de 2020). Alumínio de cloreto tópico. Recuperado de: rxlist.com

