Estrutura do ácido sulfidrico (H2S), propriedades, usos, importância
- 1122
- 98
- Ernesto Bruen
Ele ácido sulfidrico o O hidrogênio sulfeto é um gás formado pela união de um (s) átomo (s) de enxofre e dois átomos de hidrogênio (H). Sua fórmula química é H2S. Também é conhecido como gás de sulfeto. É um gás incolor cujo cheiro se torna evidente em ovos podres.
Está presente em vulcões e fontes termais sulfurosas, em gás natural e petróleo bruto. Também é formado durante a decomposição anaeróbica (sem oxigênio) da matéria orgânica de plantas e animais. Ocorre naturalmente no corpo de mamíferos, através da ação de certas enzimas em cisteína, um aminoácido não essencial.
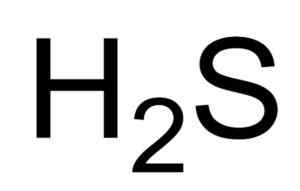
 Fórmula química de ácido sulfidrico ou sulfeto de hidrogênio. Saranphong Yimklan [domínio público]. Fonte: Wikimedia Commons.
Fórmula química de ácido sulfidrico ou sulfeto de hidrogênio. Saranphong Yimklan [domínio público]. Fonte: Wikimedia Commons. As soluções aquosas de H2S são corrosivos para metais como aço. O h2S é um composto redutor que, ao reagir com o SO2 , Oxida o enxofre elementar enquanto reduz a So2 Também para enxofre.
Apesar de ser um composto altamente tóxico e fatal para humanos e animais, por alguns anos sua importância foi estudada em uma série de processos importantes no corpo.
Regula uma série de mecanismos relacionados à geração de novos vasos sanguíneos e ao funcionamento do coração.
Proteger os neurônios e pensar em sua ação contra doenças como Parkinson e Alzheimer.
Devido à sua redução química, pode combater espécies oxidantes, agindo contra o envelhecimento celular. Por esses motivos, a possibilidade de produzir medicamentos está sendo estudada que, quando fornecidos aos pacientes, pode liberá -lo lentamente no corpo.
Isso serviria para tratar patologias como isquemia, diabetes e doenças neurodegenerativas. No entanto, seu mecanismo de ação e sua segurança ainda devem ser investigados em profundidade.
[TOC]
Estrutura
A molécula H2S é análogo ao da água, ou seja, eles se assemelham à sua forma porque os hidrogênios estão localizados formando um ângulo com enxofre.
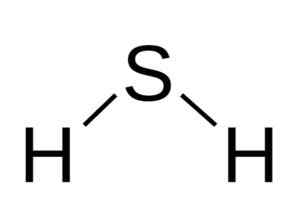 Estrutura angular da molécula de ácido sulfeto, H2S. Bangin [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikimedia Commons.
Estrutura angular da molécula de ácido sulfeto, H2S. Bangin [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikimedia Commons. Enxofre em h2S tem a seguinte configuração eletrônica:
1s2, 2s2 2 p6, 3s2 3p6,
Em seguida, pegue um elétron de cada hidrogênio para completar sua camada de valência.
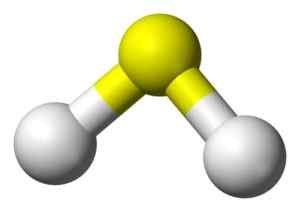 Estrutura 3D do ácido sulfeto. Amarelo: enxofre. Branco: hidrogênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura 3D do ácido sulfeto. Amarelo: enxofre. Branco: hidrogênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
- Ácido sulfidrico
- Sulfato de hidrogênio
- Hidreto de enxofre.
Propriedades físicas
Estado físico
Gás incolor de cheiro muito desagradável.
Peso molecular
34,08 g/mol.
Ponto de fusão
-85,60 ºC.
Ponto de ebulição
-60,75 ºC.
Densidade
1.1906 g/l.
Solubilidade
Moderadamente solúvel em água: 2,77 volumes em 1 água a 20 ºC. Pode ser despejado da solução aquosa completamente, enviando -a para ferver.
Propriedades quimicas
Em solução aquosa
Quando o sulfeto de hidrogênio está em solução aquosa, o nome do ácido sulfidrico é atribuído. É um ácido fraco. Tem dois prótons ionizáveis:
H2S + h2Ou ⇔ h3QUALQUER+ + Hs-, KA1 = 8,9 x 10-8
Hs- + H2Ou ⇔ h3QUALQUER+ + S2-, KA2 ∼ 10-14
O primeiro próton é levemente ionizado, como pode ser deduzido de sua primeira constante de ionização. O segundo próton é muito pouco ionizado, mas as soluções de H2S contém algo do ânion de enxofre s2-.
Se a solução H2S é exposto ao ar, o O2 Oxida ao ânion sulfeto e precipita de enxofre:
Pode atendê -lo: óxidos2 s2- + 4 h+ + QUALQUER2 → 2 h2O + 2 s0↓ (1)
Na presença de cloro cl2, Bromo Br2 e iodo i2 O hidrogênio e o enxofre correspondentes são formados:
H2S + BR2 → 2 hbr + s0↓ (2)
As soluções aquosas de H2S são corrosivos, produzem rachaduras no estresse com sulfeto em aços rígidos altos. Os produtos de corrosão são ferro e sulfeto de hidrogênio.
Reação de oxigênio
O h2S reage com o oxigênio do ar e as seguintes reações podem ocorrer:
2 h2S + 3 o2 → 2 h2O + 2 Então2 (3)
2 h2S + o2 → 2 h2O + 2 s0↓ (4)
Reação com metais
Ele reage com vários metais que se movem ao hidrogênio e formam sulfeto de metal:
H2S + pb → pbs + h2↑ (5)
Reação com dióxido de enxofre
Nos gases vulcânicos, o h está presente2S e o SO2, que reagem um com o outro e o enxofre sólido é formado:
H2S + SO2 → 2 h2O + 3 s0↓ (6)
Decomposição com temperatura
O sulfeto de hidrogênio não é muito estável, é facilmente quebrado por aquecimento:
H2S → h2↑ + s0↓ (7)
Localização na natureza
Este gás é encontrado naturalmente em fontes termais sulfídicas ou sulfurosas, em gases vulcânicos, em petróleo bruto e gás natural.
 Água sulfurosa Manantial. O.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons.
Água sulfurosa Manantial. O.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons. Quando o petróleo (ou gás) contém traços significativos de H2S é considerado "azedo", em contraste com "Sweet", que é quando não o contém.
Pequenas quantidades de H2S em petróleo ou gás são economicamente prejudiciais porque uma planta de lavagem deve ser instalada para removê -la, tanto para evitar a corrosão quanto para tornar o gás residual seguro para uso doméstico como combustível.
Ocorre sempre que a matéria orgânica que contém enxofre é decomposta em condições anaeróbicas (ausência de ar), como humano, animais e resíduos vegetais.
 H emissões2S (cor verde azulada) na costa da Namíbia, fotografada pela NASA. Essas emissões vêm de resíduos orgânicos. Observatório da Terra da NASA [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]. Fonte: Wikimedia Commons.
H emissões2S (cor verde azulada) na costa da Namíbia, fotografada pela NASA. Essas emissões vêm de resíduos orgânicos. Observatório da Terra da NASA [CC por 2.0 (https: // CreativeCommons.Org/licenças/por/2.0)]. Fonte: Wikimedia Commons. As bactérias presentes na boca e no trato gastrointestinal a produzem a partir dos materiais degradáveis que vegetais ou proteínas animais contêm.
Seu cheiro característico faz com que sua presença em ovos podres seja avisada.
O h2S também ocorre em certas atividades industriais, como nas refinarias de petróleo, fornos de coca, fábricas de papel, você teria e no processamento de alimentos.
Síntese no corpo de mamíferos
O h2S endógeno pode ocorrer em tecidos de mamíferos, entre esses ser humanos, por dois caminhos, um enzimático e não -enzimático.
O caminho não -enzimático consiste em reduzir o enxofre elementar S0 para h2S através da oxidação da glicose:
2 c6H12QUALQUER6 (glicose) + 6 s0 (enxofre) + 3 h2O → 3 C3H6QUALQUER3 + 6 h2S + 3 co2 (8)
Pode atendê -lo: cloro: história, propriedades, estrutura, riscos, usosO caminho enzimático consiste em H h2S da L-cisteína, que é um aminoácido sintetizado pelo corpo. O processo é segurado por várias enzimas, como cistação.
 O ácido sulfidrico foi encontrado no cérebro de vacas. Autor: Arttower. Fonte: Pixabay.
O ácido sulfidrico foi encontrado no cérebro de vacas. Autor: Arttower. Fonte: Pixabay. Obtenção em laboratório ou industrialmente
Gás de hidrogênio (H2) e o (s) elemento (s) de enxofre não reage às temperaturas ambientais normais, mas acima deles eles começam a ser combinados, sendo a temperatura ideal 310 ºC.
O processo é, no entanto, muito lento, então outros métodos são usados para obtê -lo, entre eles o seguinte.
Sulfídios de metal (como sulfeto ferroso) estão reagindo com ácidos (como cloridricos) em solução diluída.
FES + 2 HCl → FECL2 + H2S ↑ (9)
Dessa maneira, o gás é obtido2S que, dada a sua toxicidade, deve ser coletada com segurança.
Uso industrial de H2S para produzir enxofre
Armazenamento e transporte em grandes quantidades de H2S que se separa do gás natural por lavagem com aminas é difícil, para que o processo do Claus seja usado para transformá -lo em enxofre.
 Nas refinarias de petróleo, o H está separado2S de gás natural lavando com aminas e depois se torna enxofre. Autor: Satyaprem. Fonte: Pixabay.
Nas refinarias de petróleo, o H está separado2S de gás natural lavando com aminas e depois se torna enxofre. Autor: Satyaprem. Fonte: Pixabay. Neste processo, duas reações ocorrem. No primeiro2S reage com oxigênio para dar assim2, Como mencionado acima (ver reação 3).
O segundo é um reação catalisado por óxido de ferro onde o SO2 é reduzido e h2S oxida e os dois produzem enxofre (ver reação 6).
Dessa maneira, é obtido enxofre, que pode ser facilmente armazenado e transportado, além de alocar a múltiplos usos.
Utilidade ou importância de H2S endógeno no organismo
O h2S Endogênio é aquele que ocorre naturalmente no organismo como parte do metabolismo normal em humanos, mamíferos e outros seres vivos.
Apesar de sua longa reputação de ser um gás tóxico e venenoso associado à decomposição da matéria orgânica, vários estudos recentes dos anos 2000 até o presente determinaram que H2S endogênio é um importante regulador de certos mecanismos e processos em ser vivo.
O h2S apresenta alta lipofilicidade ou afinidade em relação a gorduras, por isso cruza as membranas celulares facilmente, penetrando em todos os tipos de células.
Sistema cardiovascular
Nos mamíferos, o ácido sulfeto promove ou regula uma série de sinais que regulam o metabolismo, a função cardíaca e a sobrevivência celular.
Ele exerce um efeito poderoso no coração, vasos sanguíneos e elementos circulantes de sangue. Modula o metabolismo celular e a função mitocondrial.
Defende os rins dos danos causados pela isquemia.
Sistema gastrointestinal
Desempenhar um papel importante como um fator protetor contra danos à mucosa gástrica. Estima -se ser um importante mediador da motilidade gastrointestinal.
É provável que esteja envolvido no controle da secreção de insulina.
Sistema nervoso central
Ele também atua em funções importantes do sistema nervoso central e protege os neurônios de estresse oxidativo.
 Os neurônios estão protegidos por H2S endógeno. Autor: Gerd Altmann. Fonte: Pixabay.
Os neurônios estão protegidos por H2S endógeno. Autor: Gerd Altmann. Fonte: Pixabay. Estima -se que possa proteger contra doenças neurodegenerativas, como a doença de Parkinson, Alzheimer e Hunginton's.
Órgão de visão
Proteger as células fotorreceptoras da degeneração da retina induzida pela luz.
Pode atendê -lo: carbonato de lítio (li2CO3): estrutura, propriedades, usosContra o envelhecimento
O h2S ser uma espécie redutora pode ser consumida por uma variedade de agentes oxidantes circulando no corpo. Espécies oxidantes de combate, como espécies reativas de oxigênio e espécies reativas de nitrogênio no corpo.
Limitar as reações dos radicais livres através da ativação de enzimas antioxidantes que protegem contra os efeitos do envelhecimento.
Potencial de cura de H2S fornecido exogenamente
A biodisponibilidade de H2S Endogênico depende de certas enzimas envolvidas na biossíntese de cisteína em mamíferos.
Alguns estudos sugerem que um doador de terapia medicamentosa Don2S pode ser benéfico para certas patologias.
Por exemplo, pode ser útil em pacientes diabéticos, pois foi observado que os vasos sanguíneos de animais diabéticos melhoram com medicamentos que fornecem h2S exógeno.
O h2S Fornecido aumenta exogenamente a angiogênese ou a formação de vasos sanguíneos, para que possa servir para o tratamento de doenças crônicas de isquemia.
Drogas estão sendo elaboradas que podem liberar H2Está lentamente para ser capaz de agir benéfico sobre várias doenças. No entanto, a eficácia, a segurança e os mecanismos de sua ação ainda devem ser investigados.
Riscos
O h2S é um veneno fatal se for inalado puro ou até diluído 1 parte do gás em 200 partes do ar. Os pássaros são muito sensíveis a H2S e morrem mesmo em diluição de 1 em 1500 partes do ar.
 Sulfeto ácido ou sulfeto de hidrogênio H2S é um veneno poderoso. Autor: Openicons. Fonte: Pixabay.
Sulfeto ácido ou sulfeto de hidrogênio H2S é um veneno poderoso. Autor: Openicons. Fonte: Pixabay. O h2S é um inibidor poderoso de certas enzimas e processos de fosforilação oxidativa, o que leva à asfixia celular. A maioria das pessoas o percebe de maneira olfatorial em concentrações superiores a 5 ppb (peças por bilhão). As concentrações de 20-50 ppm (partes por milhão) são irritantes para os olhos e o trato respiratório.
Uma inalação de 100-250 ppm por alguns minutos pode gerar falta de coordenação, distúrbios da memória e distúrbios motores. Quando a concentração é de cerca de 150-200 ppm2S. Se uma concentração de 500 ppm for inalada por 30 minutos, edema pulmonar e pneumonia podem ser produzidos.
Concentrações superiores a 600 ppm podem ser fatais nos primeiros 30 minutos, uma vez que o sistema respiratório está paralisado. E 800 ppm é a concentração que é imediatamente letal para o ser humano.
Portanto, deve -se evitar que haja H escape2S em laboratórios, local ou em qualquer lugar ou situação.
É importante alertar que muitas mortes ocorram porque as pessoas entram em espaços confinados para resgatar colegas de trabalho ou familiares que entraram em colapso devido a envenenamento com H2S, morrendo -os também.
É um gás inflamável.
Referências
- Panthi, s. et al. (2016). Importância fisiológica do sulfeto de hidrogênio: neuroprotetor e neuromodulador emergente POTNT. Medicina oxidativa e longevidade celular. Volume 2016. ID do artigo 9049782. Hyndowi se recuperou.com.
- Shefa, u. et al. (2018). Funções antioxidantes e de sinalização celular de sulfeto de hidrogênio no sistema nervoso central. Medicina oxidativa e longevidade celular. Volume 2018. ID do artigo 1873962. Hyndowi se recuperou.com.
- Tabassum, r. et al. (2020). Importância terapêutica do sulfeto de hidrogênio em doenças neurodegenerativas associadas à idade. Regen neural res 2020; 15: 653-662. Nrronline recuperou.org.
- Martelli, a. et al. (2010). Sulfeto de hidrogênio: nova oportunidade para descoberta de medicamentos. Revisões de pesquisas medicinais. Volume 32, Edição 6. Recuperado da biblioteca online.Wiley.com.
- Wang, m.-J. et al. (2010). Mecanismos de angiogesia: papel do sulfeto de hidrogênio. Farmacologia e Fisiologia Clínica e Experimental (2010) 37, 764-771. Recuperado da biblioteca online.Wiley.com.
- Dalefield, r. (2017). Fumaça e outros tóxicos inalados. Sulfato de hidrogênio. Em Toxicologia Veterinária para a Austrália e Nova Zelândia. Recuperado de cientedirect.com.
- Selley, R.C. e Sonnenberg, S.PARA. (2015). As propriedades físicas e químicas do petróleo. Sulfato de hidrogênio. Em elementos da geologia do petróleo (terceira edição). Recuperado de cientedirect.com.
- Hocking, m.B. (2005). Enxofre e ácido sulfúrico. Claus Process Conversão de sulfeto de hidrogênio em enxofre. No Manual de Tecnologia Química e Controle de Poluição (terceira edição). Recuperado de cientedirect.com.
- Lefer, d.J. (2008). Importância potencial de alterações no sulfeto de hidrogênio (H2S) biodisponibilidade em diabetes. British Journal of Pharmacology (2008) 155, 617-619. Recuperado de BPSPubs.Biblioteca online.Wiley.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Sulfato de hidrogênio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Port, j.PARA. e Ibarz, J. (1965). Química Geral Moderna. 7ª edição. Editorial de Marín, S.PARA.
- « Origem da educação socialista, características, princípios, exemplos
- História do teatro neoclássico, características, representantes, obras »

