Ácido selenífrico (h2se) o que é, estrutura, propriedades, usa
- 2694
- 716
- Ernesto Bruen
 Hidrogênio seleniuro: duas moléculas de hidrogênio e um de selênio
Hidrogênio seleniuro: duas moléculas de hidrogênio e um de selênio O que é selenífrico de ácido?
Ele Ácido selenífrico o hidrogênio seleniuro é um composto inorgânico cuja fórmula química é h2ELE. É de natureza covalente e, em condições de temperatura e pressão comuns, é um gás incolor; Mas com um forte cheiro reconhecível de sua presença menor. Quimicamente, é uma tração, então o selênio tem Valência de -2 (i2-).
De todos os seleniuros, H2É o mais tóxico porque sua molécula é pequena e seu átomo de selênio tem menos impedimento estérico ao reagir. Por outro lado, seu cheiro permite que aqueles que trabalham com ele para detectá -lo em flagra.
O hidrogênio seleniuro pode sintetizar pela combinação direta de seus dois elementos: hidrogênio molecular, h2, e selênio metálico. Também pode ser obtido por dissolução de compostos ricos em selênio, como o seleniuro de ferro (II), fES, em ácido clorídrico.
Por outro lado, o ácido selenífrico é preparado dissolvendo o hidrogênio seleniuro na água; Ou seja, o primeiro é dissolvido na água, enquanto o segundo consiste em refrigerantes.
Seu principal uso é ser uma fonte de selênio na síntese orgânica e inorgânica.
Estrutura de seleniuro de hidrogênio
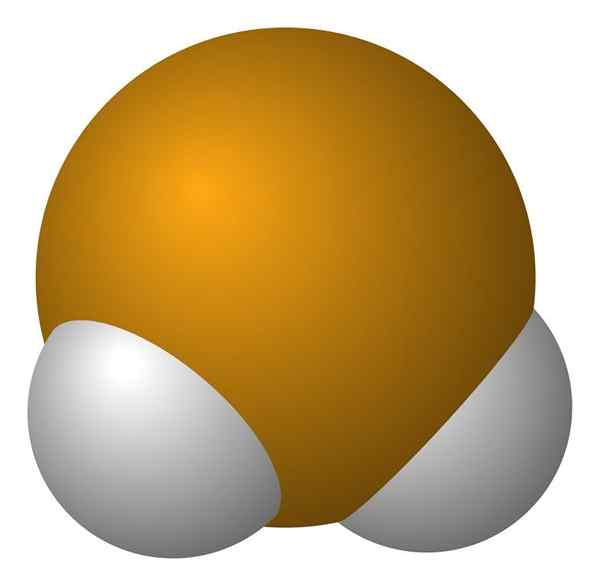
 Molécula de Seleniuro de Hidrogênio. Wikimedia Commons.
Molécula de Seleniuro de Hidrogênio. Wikimedia Commons. A molécula H2É de geometria angular, embora seu ângulo de 91 ° faça com que pareça mais um L do que para um V. Neste modelo de esferas e bares, átomos de hidrogênio e selênio são as esferas brancas e amarelas, respectivamente.
Essa molécula, como mostrado, é a que está em uma fase gasosa; isto é, para hidrogênio seleniuro. Ao se dissolver na água, ele libera um próton e, em solução, você tem o par HSE- H3QUALQUER+; Este torque de íons chega ao ácido selenífrico, indicado como H2SE (AC) para diferenciá -lo de hidrogênio seleniuro, h2SE (G).
Pode atendê -lo: azul de metileno: características, preparação, usos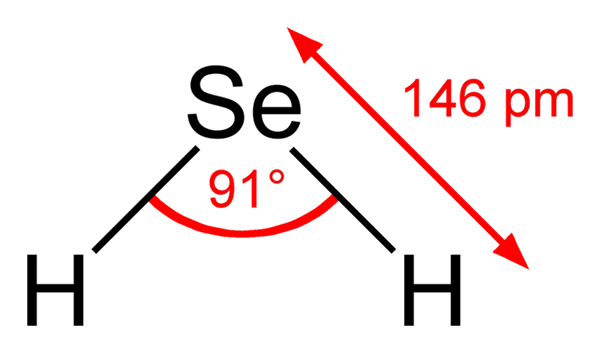 Fórmula estrutural de ácido seleenenhdric. Ben Mills, Wikimedia Commons ..
Fórmula estrutural de ácido seleenenhdric. Ben Mills, Wikimedia Commons .. Portanto, as estruturas entre H2SE (AC) e H2SE (g) são muito diferentes; O primeiro é cercado por uma esfera aquosa e possui cargas iônicas, e a segunda consiste em um aglomerado de moléculas de fase gasosa.
As moléculas H2Eles mal conseguem interagir entre si através de forças muito fracas dipolo-dipolo. O selênio, embora seja menos eletronegativo que.
Hidruitas de Selenio comprimidas
Se moléculas H2Eles sofrem pressão extraordinária (centenas de GPA), teoricamente, são forçados a solidificar pela formação de links SE-H-SE; Estes são vínculos de três centros e dois elétrons (3C-2E), onde participa de hidrogênio. Portanto, as moléculas começam a formar estruturas poliméricas que definem um sólido.
Sob essas condições, o sólido com mais hidrogênio pode ser enriquecido, o que modifica completamente as estruturas resultantes. Além disso, a composição se torna o tipo HnSE, onde n varia de 3 a 6. Assim, hidretos de selênio compactados por essas pressões e, na presença de hidrogênio, têm fórmulas químicas H3Eu conheço h6ELE.
Estima -se que esses hidratantes de selênio enriquecidos com hidrogênio tenham propriedades supercondutivas.
Propriedades
Aparência física
Gás incolor que a baixa temperatura cheira a putrefacto e ovos podres se sua concentração aumentar. Seu cheiro é pior e mais intenso que o sulfeto de hidrogênio (que já é bastante desagradável). No entanto, isso é bom, pois ajuda sua detecção fácil e diminui os riscos prolongados de contato ou inalação.
Quando queima, emite um produto de chama azulado de interações eletrônicas em átomos de selênio.
Pode atendê -lo: óxido de enxofreMassa molecular
80,98 g/mol.
Ponto de ebulição
-41 ° C.
Ponto de fusão
-66 ° C.
Pressão de vapor
9,5 atm a 21 ° C.
Densidade
3.553 g/l.
Pkpara
3.89.
Solubilidade em água
0,70 g/100 ml. Isso corrobora o fato de que o átomo de selênio de H2Você não pode formar pontes de hidrogênio apreciáveis com moléculas de água.
Solubilidade em outros solventes
-Solúvel em cs2, o que não é surpreendente pela analogia química entre selênio e enxofre.
-Fosgen solúvel (a baixas temperaturas, pois ferve a 8 ° C).
Nomenclatura
Conforme explicado nas seções anteriores, o nome deste composto varia dependendo de H2Está em um refrigerante ou fase dissolvida na água. Quando está na água, fala -se de ácido seleenhídrico, o que nada mais é do que uma hidratia em termos inorgânicos. Ao contrário das moléculas de gás, seu caráter ácido é maior.
No entanto, como gás ou dissolvido na água, o átomo de selênio mantém as mesmas características eletrônicas; Por exemplo, sua valência é -2, a menos que você sofra uma reação de oxidação. Esta valência de -2 é a razão pela qual se chama Seleniauroque de hidrogênio, uma vez que o ânion seleniuro é o2-; que é mais reativo e redutor que o S2-, sulfureto.
Se a nomenclatura sistemática for usada, o número de átomos de hidrogênio no composto deve ser especificado. Assim, h2É chamado: Seleniuro de deuhidrogênio.
Seleniuro ou hidreto?
Algumas fontes se referem a ele como um hidreto. Se realmente fosse, o selênio teria carga positiva +2 e a carga negativa de hidrogênio -1: seh2 (ELE2+, H-). O selênio é um átomo mais eletronegativo que o hidrogênio e, portanto, termina "monopolizando" a maior densidade eletrônica na molécula H2ELE.
Pode atendê -lo: termoquímicaNo entanto, como tal, a existência de hidreto de selênio não pode ser descartada. De fato, com a presença de ânions h- Isso facilitaria os links SE-H-SE, responsáveis por estruturas sólidas formadas a grandes pressões de acordo com os estudos de computador.
Formulários
Metabólico
Embora pareça contraditório, apesar da grande toxicidade de H2SE, é produzido no corpo na rota metabólica do selênio. No entanto, as células quase são produzidas como intermediárias no sintium de selenioproteínas ou acabam sendo metiladas e excretadas; Um dos sintomas disso é o sabor do alho na boca.
Industriais
O h2É usado principalmente para adicionar átomos de selênio a estruturas sólidas, como materiais semicondutores; a moléculas orgânicas, como alcenos e nitrilos para a síntese de seleniuros orgânicos; ou a uma solução para precipitar seleniuros metálicos.
Referências
- Seleneto de hidrogênio. Recuperado de: em.Wikipedia.org
- Seleneto de hidrogênio, H2ELE. Recuperado de: selênio.Atomistry.com

