Ácido fosforoso (H3po3)
- 4361
- 486
- Gilbert Franecki
 Estrutura química do ácido fosforoso. Com licença
Estrutura química do ácido fosforoso. Com licença O que é ácido fosfora?
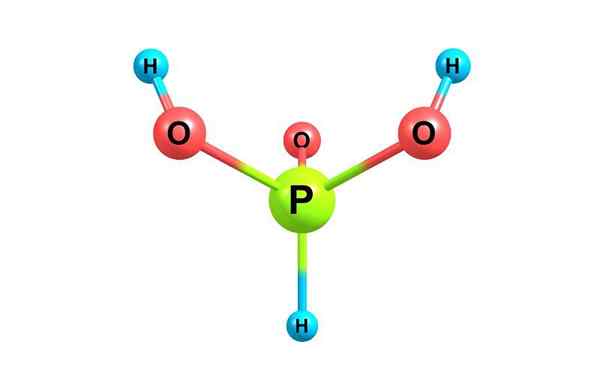
Ele ácido fosforoso, Também chamado de ácido ortofosfador, é um composto químico da fórmula H3Po3. É um dos vários ácidos oxigenados do fósforo e sua estrutura é apresentada na imagem superior.
Dada a fórmula composta, isso pode ser reescrito como HPO (OH)2. Esta espécie existe em equilíbrio com um tautômer menor P (OH)3.
As recomendações de IUPAC, 2005, são de que o último é chamado de ácido fosforoso, enquanto a forma de di -hidroxi é chamada de ácido fosfônico. Somente compostos reduzidos de fósforo são feitiços com uma terminação "urso".
O ácido fosfora é um ácido dirótico, isso significa que só tem a capacidade de produzir dois prótons. Isso ocorre porque o tautômer da maioria é H3Po3.
Quando este formulário perde um próton, a ressonância estabiliza os ânions formados. P (OH) Tautomero 3 não tem o benefício da estabilização de ressonância. Isso torna a eliminação do terceiro próton muito mais difícil.
Ácido fosfórico (H3Po3) Vendas chamadas fosfitos, que são usados como agentes redutores. É preparado dissolvendo hexoxido tetrafosfórico (P4QUALQUER6) De acordo com a equação:
P4QUALQUER6 + 6 h₂o → 4 hpo (oh)2
Ácido fósforo puro, h3Po3, É melhor preparado por tricrólise de fósforo3.
Pcl3 + 3h2O → HPO (OH)2 + 3hcl
A solução resultante é aquecida para expulsar o HCl, e o restante da água evapora até que pareça 3Po3 Colorido cristalino ao resfriar. O ácido também pode ser obtido por ação da água no PBR3 ou pi3.
Propriedades físicas e químicas do ácido fosforoso
- O ácido fosfora é um cristal tetraédrico higroscópico branco ou amarelo, com um aroma semelhante ao alho.
Pode atendê -lo: solução insaturada- O h3Po3 Tem um peso molecular de 82,0 g/mol e uma densidade de 1.651 g/ml.
- O composto tem um ponto de fusão de 73 ° C e se decompõe acima de 200 ° C.
- É solúvel em água, sendo capaz de dissolver 310 gramas por 100 ml deste solvente. Também é solúvel em etanol.
- É um ácido forte com um PKA entre 1,3 e 1,6.
- Aquecimento de ácido fosfora a aproximadamente 200 ° C torna a desproporção do ácido fosfórico e da fosfina (pH3). A fosfina é um gás que normalmente liga espontaneamente no ar.
4h3Po3 + Calor → pH3 + 3h3Po4
Reatividade e perigos
Reatividade
- O ácido fosfora não é um composto estável.
- Absorver oxigênio do ar para formar ácido fosfórico.
- Formar depósitos amarelos em solução aquosa que são espontaneamente inflamáveis ao secar.
- Reaja exotermicamente com bases químicas (por exemplo: aminas e hidróxidos inorgânicos) para formar sais.
- Essas reações podem gerar quantidades perigosamente grandes de calor em pequenos espaços.
- A dissolução da água ou diluição de uma solução concentrada com água adicional pode gerar calor significativo.
- Reage na presença de umidade com metais ativos, incluindo metais estruturais, como alumínio e ferro, para liberar hidrogênio, um gás inflamável.
- Você pode iniciar a polimerização de certos alcenos. Reage com compostos de cianeto para liberar cianeto de hidrogênio gasoso.
- Pode gerar gases inflamáveis e / ou tóxicos em contato com ditiocarbamatos, isocianos, comerciantes, nitretos, nitrilos, sulfetos e agentes reduzidos fortes.
- Reações adicionais de geração de gás são produzidas com sulfitos, nitritos, tiossulfatos (para dar H2S e SO3), Dionitos (para dar SO2) e carbonatos (para dar CO₂).
Pode atendê -lo: Einstenio (s): estrutura, propriedades, obtenção, usosPerigos
- O composto é corrosivo para olhos e pele.
- O contato visual pode resultar em danos à córnea ou cegueira.
- O contato da pele pode produzir inflamação e bolhas.
- A inalação de poeira produzirá irritação do trato gastrointestinal ou respiratório, caracterizado por queima, espirros e tosse.
- Uma superexposição severa pode causar danos pulmonares, asfixia, perda de conhecimento ou morte.
Ação em caso de dano
- Certifique -se de que a equipe médica esteja ciente dos materiais envolvidos e tenha precauções para se proteger.
- A vítima deve ser movida para um novo local e ligar para o serviço médico de emergência.
- A respiração artificial deve ser dada se a vítima não estiver respirando.
- O método da boca a boca não deve ser usado se a vítima ingeriu ou inalou a substância.
- A respiração artificial é realizada com a ajuda de uma máscara de bolso equipada com uma válvula unidirecional ou outro dispositivo respiratório adequado.
- O oxigênio deve ser administrado se a respiração for difícil.
- Roupas e sapatos contaminados devem ser removidos e isolados.
- Em caso de contato com a substância, enxágue a pele ou os olhos imediatamente com água corrente por pelo menos 20 minutos.
- Para um menor contato com a pele, o material deve ser evitado na pele inabalável.
- Mantenha a vítima calma e quente.
- Os efeitos da exposição (inalação, ingestão ou contato com a pele) podem ser atrasados.
Usos de ácido fosforoso
- O uso mais importante do ácido fosforoso é a produção de fosfitos usados no tratamento de água. O ácido fosfórico também é usado para preparar sais fosfitos, como fosfito de potássio.
Pode servir você: Boyle Law- Os fosfitos demonstraram eficácia no controle de uma variedade de plantas.
- Em particular, o tratamento por injeção de tronco ou foliar, que contém sais de ácido fosforoso, é indicado em resposta a infecções devido a patógenos vegetais de fitoftera e tipo de pythium (produz a decomposição da raiz).
- Ácido fosfora e fosfitos são usados como agentes redutores em análise química. Uma nova síntese conveniente e escalável de ácidos fenilacéticos, através da redução catalisada pelo iodeto de ácido mandélico, é baseado na geração de ácido iodidechic in -sitter do iodado de sódio catalítico do iodeto de sódio catalítico. Para isso, o ácido fosfórico é usado como redutor estequiométrico.
- É usado como ingrediente para a produção de aditivos usados na indústria de poli (cloreto de vinil). Além disso, os ésteres do ácido fosfora são usados em várias reações de síntese orgânica.
Referências
- Ácido fosforoso (H3po3). Recuperado da Britannica.com.
- Ácido muncônico. Recuperado de ebi.AC.Reino Unido.

