Estrutura do ácido crômico, propriedades, obtenção, usos

- 974
- 222
- Lonnie MacGyver
Ele ácido crômico ou h2Cro4 O ácido associado ao óxido de cromo (VI) ou óxido cro crômico é teoricamente3. Essa denominação se deve ao fato de que nas soluções aquosas ácidas do óxido crômico a espécie h2Cro4 Está presente com outras espécies de cromo (vi).
Óxido crômico3 Também é chamado de ácido crômico anidro. O cro3 É um sólido marrom avermelhado ou roxo que é obtido ao tratar soluções de dicromato de potássio k2Cr2QUALQUER7 Com ácido sulfúrico H2SW4.
 Esmagamentos de óxido crômico3 Em um caldeirão. Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikipedia Commons.
Esmagamentos de óxido crômico3 Em um caldeirão. Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikipedia Commons. As soluções aquosas de óxido crômico experimentam um equilíbrio de certas espécies químicas cuja concentração depende do pH da solução. PH básico predominam íons cromatos cro42-, Enquanto os íons ácidos hcro predominam4- e cr dicromato2QUALQUER72-. Estima -se que o ácido ácido também esteja presente no ácido crômico H2Cro4.
Devido ao seu grande poder de oxidação, as soluções de ácido crômico são usadas na química orgânica para realizar reações de oxidação. Eles também são usados em processos eletroquímicos para tratar metais, para que adquiram resistência à corrosão e desgaste.
Certos materiais poliméricos também são tratados com ácido crômico para melhorar sua adesão a metais, pinturas e outras substâncias.
As soluções de ácido crômico são altamente perigosas para humanos e a maioria dos animais e para o meio ambiente. Por esse motivo, os processos líquidos ou sólidos resíduos onde o ácido crômico é usado são tratados para eliminar o cromo (VI) ou para recuperar todo o cromo atual e regenerar o ácido crômico para reutilizá -lo.
[TOC]
Estrutura
A molécula de ácido crômico H2Cro4 É formado por um cro -cro -íon42- e dois íons de hidrogênio H+ Unido a isso. No íon cromato, o elemento de cromo está em um estado de oxidação de +6.
A estrutura espacial do íon cromato é tetraédrica, onde o cromo está no centro e o oxigênio ocupa os quatro vértices do tetraedro.
No ácido crômico, os átomos de hidrogênio estão próximos a um oxigênio. Das quatro ligações de cromo com os átomos de oxigênio, dois são duplos e dois são simples, pois eles têm os hidrogênios unidos a eles.
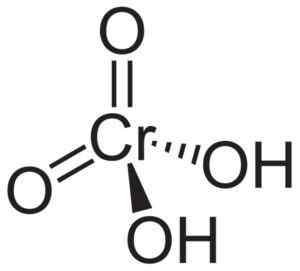 Estrutura do ácido crômico H2Cro4 onde a forma tetraédrica de cromato e suas ligações duplas são observadas. Neuroteker [domínio público]. Fonte: Wikipedia Commons.
Estrutura do ácido crômico H2Cro4 onde a forma tetraédrica de cromato e suas ligações duplas são observadas. Neuroteker [domínio público]. Fonte: Wikipedia Commons. Por outro lado, óxido cro -croomico3 Possui um átomo de cromo de oxidação +6 cercado por apenas três átomos de oxigênio.
Nomenclatura
- Ácido crômico h2Cro4
- Ácido tetraoxocrômico h2Cro4
- Óxido crômico (ácido crômico anidro) CRO3
- Trioxido de cromo (ácido crômico anidro) CRO3
Propriedades
Estado físico
Ácido anidro -hidro ou óxido crômico é um sólido cristalino de roxo a vermelho
Peso molecular
Cro3: 118,01 g/mol
Ponto de fusão
Cro3: 196 ºC
Acima do seu ponto de fusão, está termicamente instável, perde oxigênio (é reduzido) para dar óxido de cromo (III) CR2QUALQUER3. Se decompõe em aproximadamente 250 ºC.
Densidade
Cro3: 1,67-2,82 g/cm3
Solubilidade
O cro3 É muito solúvel em água: 169 g/100 g de água a 25 ºC.
É solúvel em ácidos minerais, como sulfúrico e nítrico. Álcool solúvel.
Outras propriedades
O cro3 É muito higroscópico, seus cristais são deliciosos.
Quando o CRO3 Ele se dissolve em formas de água fortemente ácidas.
Pode atendê -lo: titânio: história, estrutura, propriedades, reações, usosÉ um oxidante muito poderoso. Oxy matéria vigorosamente orgânica em quase todas as suas formas. Ataca o tecido, couro e alguns plásticos. A maioria dos metais também ataca.
É fortemente venenoso e muito irritante devido ao seu alto potencial oxidante.
Química de soluções aquosas onde o ácido crômico está presente
Óxido crômico3 Se dissolve rapidamente na água. Em solução aquosa, o cromo (VI) pode existir em diferentes formas iônicas.
Um pH> 6,5 ou em solução alcalina cromo (vi) adquire a forma de íons cromato42- amarelo.
Se o pH diminuir (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , que pode dimerizar para ion dicromato cr2QUALQUER72-, E a solução se torna laranja. A pH entre 2,5 e 5,5, as espécies predominantes são hcro4- e cr2QUALQUER72-.
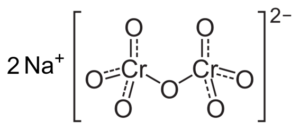 Estrutura de íons de dicromato Cr2QUALQUER72- que fica ao lado de dois íons Na Sodium NA+. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons.
Estrutura de íons de dicromato Cr2QUALQUER72- que fica ao lado de dois íons Na Sodium NA+. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons. Os saldos que ocorrem nessas soluções quando o pH diminui são os seguintes:
Cro42- (íon cromato) + h+ ⇔ Hcro4-
Hcro4- + H+ ⇔ h2Cro4 (ácido crômico)
2hcro4- ⇔ cr2QUALQUER72- (Íons de dicromato) + h2QUALQUER
Esses saldos ocorrem apenas se o ácido adicionado para diminuir o pH for3 ou hclo4, porque com outros ácidos diferentes compostos são formados.
As soluções ácidas do dicromato são agentes oxidantes muito energéticos. Mas em soluções alcalinas, o íon cromato é muito menos oxidante.
Obtenção
De acordo com as fontes consultadas, uma das maneiras de obter o óxido cro crômico3, Isso consiste em adicionar ácido sulfúrico a uma solução aquosa de dicromato de sódio ou potássio, formando um precipitado vermelho-laranja.
 Óxido crômico hidratado ou ácido crômico. HIMSTAKAN [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikipedia Commons.
Óxido crômico hidratado ou ácido crômico. HIMSTAKAN [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikipedia Commons. Ácido crômico h2Cro4 É encontrado em soluções aquosas de óxido crômico em meio ácido.
Utiliza o ácido crômico
Na oxidação de compostos químicos
Devido à sua capacidade de oxidação fortemente, o ácido crômico tem sido usado há muito tempo e com sucesso para oxidar compostos orgânicos e inorgânicos.
Among innumerable examples are the following: It allows oxidizing primary alcohols to aldehydos and these to carboxylic acids, alcohols secondary to ketones, toluene to benzoic acid, ethylbenzene to acetophenone, trifenylmetano to trifenylcarbinol, formic acid a co -co2, ácido oxálico para CO2, ácido lático para acetaldeído e co2, Fé ferrosa2+ Uma fé férrica fé3+, iodeto de íons para iodo, etc.
Permite a conversão de computação nitrosa em nitro-compostos, sulfídios em sulfonas. Ele intervém na síntese de cetonas baseadas em alcenos, pois oxidou os alcenos hidroborados em cetonas.
Compostos muito resistentes a oxidantes usuais, como oxigênio ou2 ou peróxido de hidrogênio H2QUALQUER2, Eles são oxidados por ácido crômico. Este é o caso de certas bastações heterocíclicas.
Em processos de anodização de metal
A anodização do ácido crômico é um tratamento eletroquímico que se aplica ao alumínio para protegê -lo por muitos anos de oxidação, corrosão e desgaste.
O processo de anodização envolve a formação eletroquímica de uma camada de óxido de alumínio ou alumina no metal. Esta camada é então selada em água quente, que é alcançada pela conversão em óxido de alumínio tri -hidratado.
A camada de óxido selada é espessa, mas é estruturalmente fraca e não é muito satisfatória para os sindicatos adesivos subsequentes. No entanto, adicionando uma pequena quantidade de ácido crômico à água de vedação, é desenvolvida uma superfície que pode formar boas ligações.
Pode atendê -lo: Lei sobre a conservação da matériaO ácido crômico na água de vedação dissolve parte da estrutura celular do tipo grosso e deixa um fino, forte, firmemente preso ao óxido de alumínio, ao qual os adesivos grudam e formam articulações fortes e duradouras.
Anodização com ácido crômico também se aplica ao titânio e suas ligas.
Em tratamentos de conversão química
O ácido crômico é usado em processos de revestimento metálico por conversão química.
Durante esse processo, os metais são submersos em soluções de ácido crômico. Isso reage e dissolve parcialmente a superfície depositando ao mesmo tempo uma fina camada de compostos de cromo complexos que interagem com o metal base.
Este processo é chamado de revestimento de conversão cromat ou cromo de conversão.
Os metais que geralmente são submetidos ao cromo de conversão são vários tipos de aço, como aço carbono, aço inoxidável e aço revestido de zinco, e vários metais não ferrosos, como ligas de magnésio, ligas de lata, ligas de alumínio, cobre, cádmio, manganês e prata.
Este tratamento fornece resistência à corrosão e brilho ao metal. Um pH mais alto do processo maior resistência à corrosão. A temperatura acelera a reação ácida.
O revestimento de várias cores pode ser aplicado, como azul, preto, dourado, amarelo e transparente. Ele também fornece uma melhor adesão à superfície metálica em relação a pinturas e adesivos.
Em superfície erodida ou picada
As soluções de ácido crômico são usadas na preparação da superfície de material termoplástico, polímeros termoestíveis e elastômeros para revestimento posterior com pinturas ou adesivos.
O h2Cro4 alcança um efeito na química da superfície e em sua estrutura, porque ajuda a aumentar sua aspereza. A combinação de mordidas e oxidação aumenta a penetração de adesivos e pode até causar mudanças nas propriedades do polímero.
Foi usado para corroer polietileno ramificado de baixa densidade, alta densidade e polipropileno linear polietileno.
É muito usado na indústria de eletro-recepção ou galvanoplastia para facilitar a adesão de polímero de metal.
Em vários usos
O ácido crômico é usado como conservante de madeira, também em materiais magnéticos e para reações químicas catálise.
Recuperação de ácido crômico
Existem muitos processos que usam ácido crômico e geram correntes ou resíduos que contêm cromo (III) que não podem ser descartados porque possuem íons cromados (VI) que são muito tóxicos ou reutilizados porque a concentração de íons cromato é muito baixa.
Sua disposição requer a redução química dos cromatos ao cromo (III), seguido de hidróxido e precipitação de filtração, que gera custos adicionais.
Por esse motivo, vários métodos foram estudados para remover e recuperar cromatos. Aqui estão alguns deles.
Através do uso de resinas
Por muitos anos, resinas de troca iônica para tratamento de água contaminadas com cromats foram usadas. Este é um dos tratamentos aprovados pela Agência de Proteção Ambiental dos EUA, ou EPA (acrônimo para inglês Agência de Proteção Ambiental).
Este método permite a recuperação do ácido crômico concentrado, pois é regenerado novamente da resina.
As resinas podem ser base fortes ou fracas. Em resinas fortemente básicas, o cromato pode ser removido como íons hcro4- e cr2QUALQUER72- Eles são trocados com íons oh- e cl-. Em resinas fracamente básicas, por exemplo, sulfato, os íons são trocados com SOS42-.
Pode atendê -lo: nepelometriaNo caso de resinas fortemente básicas R- (OH), as reações globais são as seguintes:
2roh + hcro4- + H+ ⇔ r2Cro4 + 2h2QUALQUER
R2Cro4 + 2hcro4- 2rhcro4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2QUALQUER7 + H2QUALQUER
Para cada mol de R2Cro4 A conversão de um mol de Cr (VI) da solução é removida, o que torna esse método muito atraente.
Após a remoção dos cromatos, a resina é tratada com uma solução fortemente alcalina para regenerá -los em um lugar seguro. Então os cromatos são convertidos em ácido crômico concentrado para serem reutilizados.
Através da regeneração eletroquímica
Outro método é a regeneração eletroquímica do ácido crômico, que também é uma alternativa muito conveniente. Através deste procedimento, o Chrome (III) é oxidado oxidado ao Chrome (VI). O material do ânodo nesses casos é preferencialmente dióxido de chumbo.
Uso de microorganismos para limpar efluentes com restos de ácido crômico
Um método que foi investigado e ainda está em estudo é o uso de microorganismos presentes naturalmente em certos efluentes contaminados com íons cromados hexavalentes que são o conteúdo das soluções de ácido crômico.
 Efluentes nocivos para o meio ambiente. Autor: OpenClipart-Vectors. Fonte: Pixabay.
Efluentes nocivos para o meio ambiente. Autor: OpenClipart-Vectors. Fonte: Pixabay. É o caso de certas bactérias presentes nas águas de águas residuais de bronzeamento. Esses micróbios foram estudados e determinados que são resistentes aos cromatos e também são capazes de reduzir o cromo (VI) ao cromo (III), o que é muito menos prejudicial ao meio ambiente e aos seres vivos.
Por esse motivo, estima -se que eles possam ser usados como um método amigável para a remediação e desintoxicação de efluentes contaminados com ácido crômico permanece.
Riscos de ácido crômico e óxido crômico
O cro3 Não é combustível, mas pode intensificar a combustão de outras substâncias. Muitas de suas reações podem causar incêndio ou explosão.
O cro3 E as soluções de ácido crômico são poderosas pele irritante (elas podem causar dermatite), olhos (podem queimá -los) e membranas mucosas (podem causar broncasma) e podem causar as "cavilhas cromadas" assim chamadas no sistema respiratório.
Os compostos cromados (VI), como ácido crômico e óxido crômico, são gravemente tóxicos, mutagênicos e carcinogênicos para a maioria dos seres vivos.
Referências
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- OU.S. Biblioteca Nacional de Medicina. (2019). Ácido crômico. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wegman, r.F. e van Twisk, J. (2013). Ligas de alumínio e alumínio. 2.5. Processo de anodizar ácido crômico. Em técnicas de preparação de superfície para ligação adesiva (segunda edição). Recuperado de cientedirect.com.
- Wegman, r.F. e van Twisk, J. (2013). Magnésio. 6.4. Preparação de ligas de magnésio e magnésio pelos processos de tratamento com ácido crômico. Em técnicas de preparação de superfície para ligação adesiva (segunda edição). Recuperado de cientedirect.com.
- Grot, w. (2011). Formulários. 5.1.8. Regeneração do ácido crômico. Em ionômeros fluorados (segunda edição). Recuperado de cientedirect.com.
- Swift, k.G. e Booker, J.D. (2013). Processo de engenharia de superfície. 9.7. Cromando. No manual de seleção de processos de fabricação. Recuperado de cientedirect.com.
- Poulson, a.H.C. et al. (2019). Técnicas de modificação de superfície de espiada, incluindo tratamento de superfície plasmática. onze.3.2.1. Gravação de superfície. No Peek Biomaterials Handbook (segunda edição). Recuperado de cientedirect.com.
- Westheimer, f.H. (1949). Os mecanismos de oxidações do ácido crômico. Revisões químicas 1949, 45, 3, 419-451. Recuperado de bares.ACS.org.
- Tan, h.K.S. (1999). Remival de ácido crômico por troca de ânions. The Canadian Journal of Chemical Engineering, volume 77, fevereiro de 1999. Recuperado da biblioteca online.Wiley.com.
- Kabir, m.M. et al. (2018). Isolamento e caracterização de bactérias reduzidas por cromo (VI) de efluentes de curtume e resíduos sólidos. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI se recuperou.Nlm.NIH.Gov.
- « Características da paisagem industrial, elementos e exemplos
- Estrutura molecular Cyanífrica, propriedades, usa »

