Estrutura molecular Cyanífrica, propriedades, usa

- 4349
- 1126
- Tim Mann
Ele ácido hidrocianico o O cianeto de hidrogênio é um composto orgânico cuja fórmula química é HCN. Também é conhecido como metanonitril.
O ácido canífrico é um gás incolor e extremamente venenoso, que é obtido ao tratar cianetos com ácidos. Este ácido está localizado dentro da semente de pavões, também conhecida em muitos lugares como um pêssego.
 Semente de pêssego, que contém cianeto de hidrogênio ou cianeto de hidrogênio, HCN. Um.Ha [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons.
Semente de pêssego, que contém cianeto de hidrogênio ou cianeto de hidrogênio, HCN. Um.Ha [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikipedia Commons. A uma temperatura ambiente menor que 25 ºC é um líquido e acima dessa temperatura é um gás. Nos dois casos, é extremamente tóxico para o ser humano, animais e até a maioria dos microorganismos não se acostumar. É um bom solvente para íons. É muito instável porque tende a polimerizar facilmente.
É encontrado no reino vegetal incorporado nas moléculas de alguns glucosídeos, porque quando são hidrolisados por enzimas do vegetal, o HCN, a glicose e o benzaldeído são obtidos.
Esses glicosídeos estão dentro das sementes de certas frutas, como pêssegos, damasco, cerejas, ameixas e amêndoas amargas, para que nunca devem ser ingeridas.
Também é encontrado em plantas como alguns tipos de sorgo. Além disso, algumas bactérias o produzem durante o metabolismo. É usado principalmente na produção de polímeros e em alguns processos metalúrgicos.
HCN é um veneno letal devido a inalação, ingestão e contato. Está presente na fumaça do cigarro e na fumaça do fogo de plásticos e materiais que contêm carbono e nitrogênio. É considerado um poluente do ar que ocorre durante a combustão de material orgânico de extensas áreas do planeta.
[TOC]
Estrutura molecular e configuração eletrônica
O cianeto de hidrogênio ou o ácido cianeto é um composto molecular covalente, com um átomo de hidrogênio, um carbono e um de nitrogênio.
O átomo de carbono e nitrogênio compartilham 3 pares de elétrons, então eles formam um link triplo. O hidrogênio está ligado ao carbono, que com esta união apresenta sua Valencia de Cuatro e seu Octeto Eletrônico Completo.
O nitrogênio apresenta cinco valência de cinco e para concluir seu octeto tem um par de elétrons desaparecidos ou solitários localizados lateralmente.
O HCN é, portanto, uma molécula completamente linear, com alguns elétrons ausentes localizados lateralmente em nitrogênio.
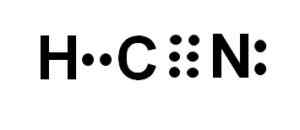 Lewis Representação do ácido canífrico, onde os elétrons compartilhados em cada ligação e o par de elétrons de nitrogênio solitários são observados. Autor: Marilú Stea.
Lewis Representação do ácido canífrico, onde os elétrons compartilhados em cada ligação e o par de elétrons de nitrogênio solitários são observados. Autor: Marilú Stea. 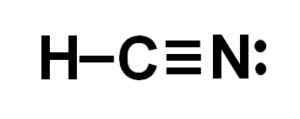 Estrutura de cianeto de hidrogênio ou cianeto de hidrogênio, onde a ligação tripla entre carbono e nitrogênio é observada. Autor: Marilú Stea.
Estrutura de cianeto de hidrogênio ou cianeto de hidrogênio, onde a ligação tripla entre carbono e nitrogênio é observada. Autor: Marilú Stea. Nomenclatura
- Ácido hidrocianico
- Cianeto de hidrogenio
- Metanonitrila
- Formonitrila
- Ácido hidrocianico
Propriedades
Estado físico
Abaixo de 25,6 ºC, se for anidro e estabilizado, é um líquido azul claro muito instável e tóxico ou azul. Se estiver acima, essa temperatura é um gás incolor extremamente venenoso.
Peso molecular
27,03 g/mol
Ponto de fusão
-13.28 ºC
Ponto de ebulição
25.63 ºC (Observe que ferve logo acima da temperatura ambiente).
Ponto de inflamação
-18 ºC (método de copo fechado)
Temperatura de autodirecionamento
538 ºC
Pode atendê -lo: cromatografia a gásDensidade
0,6875 g/cm3 A 20 ºC
Solubilidade
Totalmente miscível com água, álcool etílico e éter etílico.
Constante de dissociação
K = 2,1 x 10-9
Pkpara = 9.2 (é um ácido muito fraco)
Algumas propriedades químicas
O HCN tem uma constante dielétrica muito alta (107 a 25 ° C). Isso ocorre porque suas moléculas são muito polares e estão associadas por pontes de hidrogênio, como no caso da água H2QUALQUER.
Por ter uma constante dielétrica tão alta, o HCN acaba sendo um bom solvente ionizante.
O hCN líquido de anidro é muito instável, tende a polimerizar violentamente. Para evitar isso, os estabilizadores são adicionados, como uma pequena porcentagem de H2SW4.
Em solução aquosa e na presença de amônia e forma de adenina de alta pressão, composto que faz parte do DNA e RNA, ou seja, uma molécula biologicamente importante.
É um ácido muito fraco, uma vez que sua constante de ionização é muito pequena, por isso está parcialmente em água, dando ao ânion cianeto CN-. Formar sais com as bases, mas não com carbonatos.
Suas soluções aquosas não protegidas da luz são lentamente decompostas, gerando formação de amônio hcoonh4.
Em solução, apresenta um cheiro fraco de amêndoas.
Corrosividade
Porque é um ácido fraco, geralmente não é corrosivo.
No entanto, as soluções aquosas de HCN contendo ácido sulfúrico como estabilizador atacam fortemente aço em temperaturas maiores que 40 ºC e aço inoxidável a temperaturas maiores que 80 ° C.
Além.
Você também pode atacar alguns tipos de borracha, plásticos e revestimentos.
Localização na natureza
É relativamente abundante no reino vegetal fazer parte de glucosídeos.
Por exemplo, é gerado a partir da tonsilina C6H5-CH (-CN) -O-GLYCOSE-GLYCOSE, composto presente em amêndoas amargas. A amígdala é um beta-glucosídeo cianogênico, porque quando hidrolisado, forma duas moléculas de glicose, uma de benzaldeído e uma de HCN. A enzima que os libera é beta-glucoxidase.
A amígdala pode ser encontrada nas sementes de pêssegos, damasco, amêndoas amargas, cerejas e ameixas.
Alguns tipos de plantas de sorgo contêm o canogênico de glucó chamado Durrina (ou seja, o p-hidroxi- (S) -Mandelonitrilo-beta-d-glucosídeo). Este composto pode ser degradado por hidrólise enzimática de dois etapas.
Primeiro, a enzima Durrinosa que é endógena em plantas de sorgo hidrolys com glicose e p-hidroxi- (S) -Mandelonitrilo. Então, o último rapidamente se torna livre hcn e p-hidroxibenzaldeído.
 Planta de sorgo com alto teor de Durrina. Nenhum autor legível por máquina fornecido. Pethan assumiu (com base em reivindicações de direitos autorais). [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikipedia Commons.
Planta de sorgo com alto teor de Durrina. Nenhum autor legível por máquina fornecido. Pethan assumiu (com base em reivindicações de direitos autorais). [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikipedia Commons. O HCN é responsável pela resistência das plantas de sorgo em relação a pragas e patógenos.
Isso é explicado pelo fato de que a enzima Durrina e Durrinosa têm locais diferentes nessas plantas e entram em contato somente quando os tecidos são feridos ou destruídos, liberando o HCN e protegendo a planta de infecções que podem penetrar através da parte lesada.
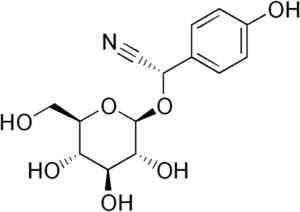 Molécula de Durrina, onde a ligação tripla CN é observada que, por hidrólise enzimática, produz HCN. Edgar181 [domínio público]. Fonte: Wikipedia Commons.
Molécula de Durrina, onde a ligação tripla CN é observada que, por hidrólise enzimática, produz HCN. Edgar181 [domínio público]. Fonte: Wikipedia Commons. Além disso, algumas bactérias patogênicas do ser humano, como Pseudomonas aeruginosa e P. Gingivalis Eles o produzem durante sua atividade metabólica.
Formulários
Na preparação de outros compostos químicos e polímeros
O uso envolvendo a maior parte do HCN produzido em nível industrial é a preparação de intermediários para a síntese orgânica.
Pode atendê -lo: óxido de ferro (ii): estrutura, nomenclatura, propriedades, usosÉ usado na síntese de adiponitrila nc- (CH2)4-CN, que é usado para preparar nylon ou nylon, uma poliamida. Também serve para preparar Acrilonitrilo ou Cianoetileno Cho2= CH-CN, usado para preparar fibras de acrílico e plástico.
Seu cianeto de sódio derivado é usado para a recuperação de ouro na mineração deste metal.
Outro de seus derivados cloreto de cianogênio serve para fórmulas de pesticidas.
O HCN é usado para a preparação de agentes quelantes, como EDTA (Ethylen-Diamino-Tetra-Acetato).
Serve para a fabricação de ferrocianetos e alguns produtos farmacêuticos.
Vários usos
O gás HCN tem sido usado como inseticida, fungicida e desinfetante, para fumigação de navios e edifícios. Também para fumigar móveis para restaurá -los.
HCN tem sido usado em polimento de metal.
Por sua alta toxicidade, ele foi nomeado como um agente de guerra química.
Na agricultura
Foi usado como herbicida e pesticida em pomares. Ele usava para controlar escalas e outros patógenos de árvores cítricas, mas algumas dessas pragas se tornaram resistentes ao HCN.
Também tem sido usado para fumigar silos de grãos. O HCN gasoso preparado no local foi usado na fumigação de grãos de trigo para preservá -los de pragas como insetos, fungos e roedores. Para este uso, é essencial que as sementes sejam fumigadas ao agente de pesticidas.
Testes fumigando sementes de trigo foram feitos com HCN e foi descoberto que o potencial de germinação deles não afeta negativamente.
No entanto, altas doses de HCN podem reduzir significativamente o comprimento de folhas pequenas que brotam da semente.
Por outro lado, devido ao fato de ser um nemático poderoso e que algumas plantas de sorgo o possuem em seus tecidos, o potencial das plantas de sorgo está sendo investigado para ser usado como fertilizante verde biocida.
Seu uso serviria para melhorar os solos, suprimir ervas daninhas e controlar doenças e danos causados por nematóides fitoparasitários.
Riscos
Para o ser humano, o HCN é um veneno letal em todas as rotas: inalação, ingestão e contato.
 Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay.
Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay. Inalado pode ser letal. Estima-se que cerca de 60-70% da população possa detectar o cheiro de amêndoas de HCN amargo quando está no ar a uma concentração de 1-5 ppm.
Mas há 20% da população que ainda não pode detectá -la em concentrações letais por ser geneticamente incapaz de fazê -lo.
Ingerido é um veneno agudo e imediato.
Se suas soluções entrarem em contato com a pele, o cianeto associado pode ser letal.
O HCN está presente na fumaça do cigarro e aquele que é gerado quando plásticos que contêm nitrogênio são queimados.
Mecanismo de ação letal dentro do organismo
É um produto químico e é rapidamente tóxico, frequentemente levando à morte. Ao entrar no organismo, ele se junta às metaloenzimas (enzimas que contêm um íon metal) inativando -as. É um agente tóxico para vários órgãos do corpo humano
Seu principal efeito tóxico consiste na inibição da respiração celular, pois desativa uma enzima que influencia a fosforilação nas mitocôndrias, que são organelas que intervêm, entre outras coisas, na função respiratória das células.
Pode atendê -lo: Permanganato de potássio (KMNO4)Risco de fumaça de cigarro
O HCN está presente na fumaça do cigarro.
Embora muitas pessoas conheçam o efeito de envenenar o HCN, poucas pessoas percebem que estão expostas ao seu efeito prejudicial através da fumaça do cigarro.
O HCN é uma das causas da inibição de várias enzimas respiratórias celulares. A quantidade de HCN presente na fumaça do cigarro tem um efeito prejudicial no sistema nervoso.
Os níveis de HCN foram relatados na fumaça de cigarro entre 10 e 400 μg por cigarro para a fumaça diretamente e 0,006 a 0,27 μg/cigarro para inalação secundária (fumante passivo). O HCN produz efeitos tóxicos a partir de 40 μm.
 Autor: Alexas Fotos. Fonte: Pixabay.
Autor: Alexas Fotos. Fonte: Pixabay. Ser inalado rapidamente entra na corrente sanguínea, onde ele é liberado no plasma ou se liga à hemoglobina. Uma pequena parte se converte em tiocianato e é excretada pela urina.
Riscos de aquecimento HCN
A exposição prolongada ao calor do HCN líquido em recipientes fechados pode causar ruptura violenta e inesperada. Pode polimerizar explosivamente 50-60 ºC na presença de traços de álcalis e na ausência de inibidores.
Presença de HCN em fumaça de fogo
O HCN é liberado durante a combustão de polímeros que contêm nitrogênio, como lã, seda, poliacrilonitrilos e nylon, entre outros. Esses materiais estão presentes em nossas casas e na maioria dos locais de atividade humana.
Por esse motivo durante os incêndios, o HCN pode ser potencialmente a causa da morte pela inalação.
Atmosfera poluente
HCN é um poluente da troposfera. É resistente à fotólysia e sob as condições ambientais da atmosfera não sofre hidrólise.
OH Radicais hidroxila • Produzido Fotoquimicamente, pode reagir com o HCN, mas a reação é muito lenta; portanto, a meia -vida do HCN na atmosfera é de 2 anos.
Quando queimaduras de biomassa, especialmente MOB, o HCN é liberado para a atmosfera e também durante atividades industriais. No entanto, a combustão de turfa é 5 a 10 vezes mais poluente do que queimar outro tipo de biomassa.
Alguns pesquisadores descobriram que altas temperaturas e seca causadas pelo fenômeno El Niño em certas áreas do planeta exacerb.
 Autor: Steve Buissinne. Fonte: Pixabay.
Autor: Steve Buissinne. Fonte: Pixabay. Isso leva a uma intensa queima de biomassa em estações secas.
Esses eventos são a fonte de altas concentrações de HCN na troposfera, que eventualmente são transportadas para a estratosfera baixa, permanecendo por muito tempo.
Referências
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- OU.S. Biblioteca Nacional de Medicina. (2019). Cianeto de hidrogenio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Gidlow, d. (2017). Atualização de cianeto de hidrogênio-an. Medicina Ocupacional 2017; 67: 662-663. NCBI se recuperou.Nlm.NIH.Gov.
- Enciclopédia científica de Van Nostrand. (2005). Cianeto de hidrogenio. 9º Recuperado da biblioteca online.Wiley.com.
- Ren, e.-eu. et al. (mil novecentos e noventa e seis). Efeito do cianeto de hidrogênio e sulfeto de carbonil na germinação e vigor de plumule do trigo. Pestic. Sci. 1996, 47, 1-5. Recuperado da biblioteca online.Wiley.com.
- De Nicola, G.R. et al. (2011). Para o método analítico simples para avaliação de conteúdo de dhurrina em plantas cianogênicas para seu uso em forragem e biofumigação. J. Agric. Food Chem. 2011, 59, 8065-8069. Recuperado de bares.ACS.org.
- Sheese, p.E. et al. (2017). Um aprimoramento global do cianeto de hidrogênio na estratosfera inferior através de 2016. Geophys. Carne bovina. Lett., 44, 5791-5797. Recuperado de agupubs.Biblioteca online.Wiley.com.
- Surleva, a.R. e drochioiu, g. (2013). Visualização Perigo para fumar: Determinação espectrofotométrica simples de cianeto de hidrogênio em fumaça e filtros de cigarro. J. Chem. Educ. 2013, 90, 1654-1657. Recuperado de bares.ACS.org.
- Alarie, e. et al. (1990). Papel do cianeto de hidrogênio em mortes humanas no fogo. Em fogo e polímeros. Capítulo 3. Série do Simpósio ACS. Recuperado de bares.ACS.org.
- « Estrutura do ácido crômico, propriedades, obtenção, usos
- 8 experimentos com humanos muito controversos »

