Ácido cloro (hclo2)
- 2628
- 702
- Tim Mann
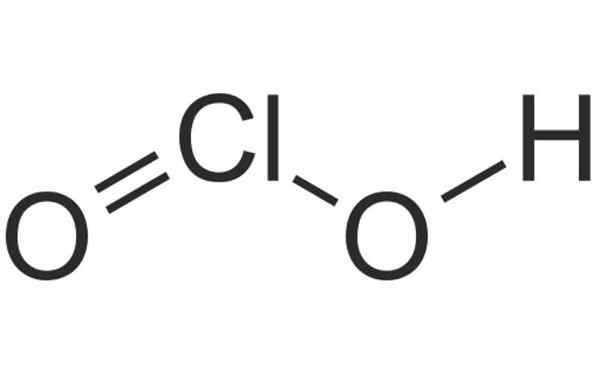
 Estrutura química do ácido de cloro. Fonte: HBF878, Wikimedia Commons
Estrutura química do ácido de cloro. Fonte: HBF878, Wikimedia Commons O que é cloro?
Ele Ácido cloro É um composto inorgânico da fórmula HCLO2. Este ácido é um dos ácidos oxácidos do cloro, onde é encontrado com o estado de oxidação 3+.
Embora seja difícil obter ácido em substância pura, a base conjugada derivada desses ácidos, o íon clorito, é estável. Um exemplo de um sal deste ânion é clorito de sódio. Este e outros sais relacionados às vezes são usados na produção de dióxido de cloro.
O ácido cloro é um ácido fraco. A substância pura é instável, desproporcional com ácido hipocloroso (status de oxidação Cl +1) e ácido clorico (estado de oxidação Cl +5):
2HCLO2 → HCLO + HCLO3
O ácido cloro é obtido, juntamente com o ácido clórico, na decomposição da solução aquosa de dióxido de cloro.
A solução do ácido cloro foi obtida pela primeira vez reduzindo o ácido clorico com ácido tartárico; no entanto, o principal método de obter esse ácido é tratar uma suspensão de cloreto de bário com ácido sulfúrico:
Ba (clo2)2 + H2SW4 → Baso4 + 2HCLO2
O ácido cloro é um agente oxidante poderoso, embora sua tendência à disseminação ou desproporção neutralize seu potencial oxidante.
O cloro é o único halogênio que forma uma fórmula isolável ácido hXO2. Nem ácido bromo nem ácido iodose foram isolados. Alguns sais de piada ácido, piadas são conhecidas, mas, exceto como intermediários nas reações, não há sais de Yoditos.
Propriedades físicas e químicas
- O ácido cloro, quando é possível isolar, é um líquido incolor sem aroma característico.
Pode atendê -lo: cicloalcinos- O composto tem um peso molecular de 68.456 g/mol. Possui um ponto de ebulição (calculado) de 502,07 ° C e 1 × 10 (calculado) solubilidade em água6 mg/l.
- O HCLO2 É instável devido à reação de dissutação (ou desproporção) produzir ácido clórico e hipocloroso, semelhante ao dos ácidos analógicos de bromo e iodo:
2HCLO2 → HCLO + HCLO3
- O ácido cloro é considerado um ácido fraco, embora sua constante de dissociação esteja na ordem de 1 x 10-2, O que não faz isso tão fraco quanto outros ácidos com um PKA de 1,96.
Riscos
O ácido cloro é um composto instável e um forte agente oxidante incompatível com agentes e álcalis redutores.
O ácido cloro é irritante em caso de contato com a pele e os olhos e é perigoso em casos de ingestão e inalação.
Em caso de contato visual, você deve verificar se as lentes de contato estão sendo usadas e removê -las imediatamente. Os olhos devem ser lavados com água corrente por pelo menos 15 minutos, mantendo as pálpebras abertas. Água fria pode ser usada, mas não uma pomada olho.
Se o produto químico entrar em contato com as roupas, retire -as o mais rápido possível, protegendo suas próprias mãos e corpo. Coloque a vítima sob um chuveiro de segurança.
Se o produto químico se acumular na pele exposta da vítima, como as mãos, a pele contaminada com água corrente e sabão não abrasivo é suavemente lavado e cuidadosamente.
Água fria pode ser usada. Se a irritação persistir, procure atendimento médico. Lave roupas contaminadas antes de usá -las novamente.
Pode atendê -lo: grupo fosfatoSe o contato da pele for grave, ele deve ser lavado com um sabão desinfetante e cobrir a pele contaminada com um creme antibacteriano.
Em caso de inalação, a vítima deve permanecer em uma área bem ventilada. Se a inalação for grave, a vítima deve ser evacuada para uma área segura o mais rápido possível. Roupas apertadas soltas, como pescoço de camisa, cintos ou gravata.
Se a vítima é difícil de respirar, o oxigênio deve ser administrado. Se a vítima não está respirando, uma ressuscitação na boca é feita. Sempre levando em consideração que pode ser perigoso para a pessoa que fornece ajuda para dar a ressuscitação boca a boca quando o material inalado é tóxico, infeccioso ou corrosivo.
Em caso de ingestão, não induz vômito. Solte as roupas apertadas. Se a vítima não estiver respirando, faça a ressuscitação da boca na boca. Em todos os casos, deve -se procurar atenção médica imediata.
Formulários
- Estudos foram realizados onde soluções meta-estáveis de óxido de ácido de cloro/cloro, como enxágue oral para redução de placas.
O estudo foi realizado para um grupo de voluntários de 18 a 27 anos. Seu efeito no desenvolvimento da placa e a contagem bacteriana salivar foi testada, obtendo uma redução de até 34,5% de redução nas pontuações das placas dentárias em comparação com um grupo placebo.
- O ácido cloro está envolvido na preparação do clorito de ácido de sódio, que possui propriedades antimicrobianas e foi projetado para uso principalmente como um spray ou uma solução de imersão para aves, carnes, legumes, frutas e alimentos marinhos. Também é usado em água de resfriamento de pássaros curral.
Pode atendê -lo: orbitais degenerados- O clorito de ácido de sódio é produzido pela adição de ácido da qualidade dos alimentos (por exemplo, ácido cítrico, ácido fosfórico, ácido clorídrico, ácido da roda ou sulfato de sulfato de hidrogênio) a uma solução aquosa de clorito de sódio (NaClo2).
A combinação de ácido com a solução de clorito de sódio resulta em conversão de clorito em um metro de cloro ácido (HCLO2).
Naclo2 + H+ ⇌ HCLO2 + N / D+
Esta solução pode subsequentemente formar uma mistura com clorito (CLO2-), dióxido de cloro (CLO2) e cloreto (CLM). A reação gera uma solução oxidativa com espécies oxicloradas com propriedades antimicrobianas.
- O clorito de ácido de sódio foi projetado para ser usado como parte de uma abordagem integrada focada no controle de cargas microbianas em alimentos.
A solução de clorito de ácido de sódio atua para reduzir o número de patógenos (por exemplo, Escherichia coli, E. Coli o157: h7, Salmonella spp., Campylobacter spp., e Listeria monocytogenes).
Referências
- Ácido cloroso. Recuperado de ebi.AC.Reino Unido.
- Centro Nacional de Informações sobre Biotecnologia. Recuperado de PubChem.

