Estrutura de ácido carbônico (H2CO3), propriedades, síntese, usos

- 3228
- 508
- Tim Mann
Ele ácido carbónico É um composto inorgânico, embora haja aqueles que debatem que é realmente orgânico, cuja fórmula química é h2Co3. É, portanto, um ácido dirótico, capaz de doar dois íons H+ ao ambiente aquoso para gerar dois cátions moleculares h3QUALQUER+. Dele os íons bicarbonato bem conhecidos (HCO3-) e carbonato (CO32-).
Esse ácido peculiar, simples, mas ao mesmo tempo envolvido em sistemas em que numerosas espécies participam de um equilíbrio de vapor líquido, é formado a partir de duas moléculas inorgânicas fundamentais: água e dióxido de carbono. A presença de CO2 Sempre é observado que há uma bolha na água, ascendendo à superfície.
 Vidro com água gaseificada, uma das bebidas mais comuns contendo ácido carbônico. Fonte: pxhere.
Vidro com água gaseificada, uma das bebidas mais comuns contendo ácido carbônico. Fonte: pxhere. Este fenômeno é visto regularmente em refrigerantes e água carbonatada.
No caso de água carbonatada ou gasificada (imagem superior), essa quantidade foi dissolvida2 que sua pressão de vapor é mais do que dupla pressão atmosférica. Ao descobrir, a diferença de pressão dentro da garrafa e o exterior diminui a solubilidade do CO2, Então as bolhas que acabam escapando do líquido aparecem.
Em menor grau2.
No entanto, o CO2 Não é apenas dissolvido, mas sofre transformações em sua molécula que o tornam o H2Co3; Um ácido que tem uma vida muito minúscula, mas o suficiente para marcar uma mudança persistente no pH de seu ambiente de solvente aquoso e também gerar um sistema de tampão de carbonato exclusivo.
[TOC]
Estrutura
Molécula
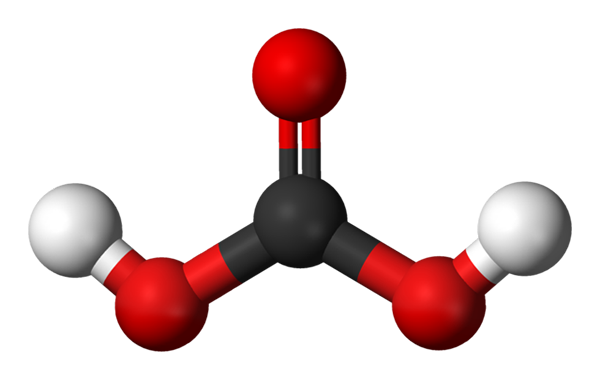 Molécula de ácido carbônico representado com um modelo de esferas e barras. Fonte: Jynto e Ben Mills via Wikipedia.
Molécula de ácido carbônico representado com um modelo de esferas e barras. Fonte: Jynto e Ben Mills via Wikipedia. Up, temos a molécula H2Co3, representado com esferas e bares. As esferas vermelhas correspondem a átomos de oxigênio, átomos de preto para carbono e átomos de hidrogênio branco.
Observe que, a partir da imagem, você pode escrever outra fórmula válida para este ácido: CO (OH)2, onde Co se torna o grupo carbonil, c = O, ligado a dois grupos hidroxila, oh. Quando há dois grupos de OH, capazes de doar seus átomos de hidrogênio, agora é entendido de onde vêm os íons h+ lançado no meio.
 Estrutura molecular do ácido carbônico.
Estrutura molecular do ácido carbônico. Observe que a fórmula Co (OH)2 Pode ser escrito como Ohcooh; isto é, do tipo rcooh, onde r se torna neste caso um grupo OH.
É por esse motivo, além do fato de que a molécula consiste em oxigênio, hidrogênio e átomos de carbono, muito comum na química orgânica, que o ácido carbônico é considerado por alguns como um composto orgânico. No entanto, na seção de sua síntese, será explicado por que outros consideram isso de natureza inorgânica e não orgânica.
Pode atendê -lo: di -hidroxiacetona: estrutura, propriedades, obtenção, usosInterações moleculares
Da molécula H2Co3 Pode -se comentar que sua geometria é trigonal, com o carbono localizado no centro do triângulo. Em dois de seus vértices, possui os grupos OH, que são doadores de pontes de hidrogênio; E no outro restante, um átomo de oxigênio do grupo C = O, aceitador de ponte de hidrogênio.
Assim, h2Co3 Tem uma forte tendência a interagir com protestos ou solventes oxigenados (e também nitrogênio).
E coincidentemente, a água atende a essas duas características, e a afinidade de H é tal2Co3 para ela que quase imediatamente lhe dá um h+ E um equilíbrio de hidrólise que envolve espécies de HCO começa a ser estabelecido3- e h3QUALQUER+.
É por isso que a mera presença de água decompõe o ácido carbônico e torna seu isolamento como composto puro muito complicado.
Ácido carbônico puro
Retornando à molécula H2Co3, Não é apenas plana, capaz de estabelecer pontes de hidrogênio, mas também pode apresentar cis-trans-isomeía; Esta é, na imagem, temos o isômero cis, com os dois H apontando na mesma direção, enquanto no isômer trans apoiariam em direções opostas.
O isômero cis é o mais estável de ambos, e é por isso que é o único que geralmente é representado.
Um sólido puro de H2Co3 Consiste em uma estrutura cristalina composta por camadas ou moléculas folhas interagindo com pontes laterais de hidrogênio. Isso é esperado, sendo a molécula H2Co3 Plano e triangular. Quando Subblimal, Crepúsculo cíclico aparece (H2Co3)2, que são unidos por duas pontes de hidrogênio c = o - oh.
A simetria do RH2Co3 Não foi capaz de ser definido pelos momentos. Foi considerado cristalizado como dois polimorfos: α-h2Co3 e β-h2Co3. No entanto, α-h2Co3, sintetizado com base em uma mistura de CHO3COOH-CO2, Foi demonstrado que era realmente CHO3OROH: uma monometria de ácido carbônico STER.
Propriedades
Foi mencionado que h2Co3 É um ácido dirótico, para que você possa doar dois íons H+ para um meio que os aceita. Quando este meio é água, as equações de sua dissociação ou hidrólise são:
H2Co3(AC) + H2Ou (l) HCO3-(AC) + H3QUALQUER+(AC) (KA1 = 2,5 × 10-4)
HCO3-(AC) + H2Ou (l) CO32-(AC) + H3QUALQUER+(AC) (KA2 = 4,69 × 10-11)
O HCO3- É o ânion bicarbonato ou hidrogenocarbonato, e o CO32- O ânion carbonato. Eles também indicam suas respectivas constantes de equilíbrio, ka1 e ka2. Sendo ka2 cinco milhões de vezes menor que o ka1, A formação e concentração de CO32- Eles são desprezíveis.
Então, mesmo que seja um ácido dirótico, o segundo H+ Você mal pode liberá -lo apreciável. No entanto, a presença de CO2 dissolvido em grandes quantidades suficientes para acidificar o meio; Nesse caso, a água, diminuindo seus valores de pH (abaixo de 7).
Pode servir você: fusãoFalar sobre ácido carbônico está praticamente se referindo a uma solução aquosa em que as espécies de HCO predominam3- e h3QUALQUER+; Não pode ser isolado pelos métodos convencionais, uma vez que as menores tentativas substituiriam o equilíbrio da solubilidade do CO2 para a formação de bolhas que escapariam da água.
Síntese
Dissolução
O ácido carbônico é um dos compostos mais fáceis de sintetizar. Como? O método mais simples é borbulhar, com a ajuda de uma palha ou sorvete, o ar que exalamos dentro de um volume de água. Porque nós expiramos em Essence Co2, Esta bolha na água, dissolvendo uma pequena fração do mesmo.
Quando fazemos isso, ocorre a seguinte reação:
Co2(g) + h2Ou (l) h2Co3(AC)
Mas, por sua vez, a solubilidade do CO deve ser considerada2 na água:
Co2(G) CO2(AC)
Ambos co2 como h2Ou são moléculas inorgânicas, então H2Co3 É inorgânico desde esse ponto visto.
Equilíbrio de vapor líquido
Como resultado, temos um sistema em equilíbrio que depende muito das pressões parciais do CO2, bem como temperatura líquida.
Por exemplo, se a pressão do CO2 Aumenta (no caso de soprarmos o ar com mais força através do sorvete), mais H formará2Co3 e o pH se tornará mais ácido; Desde então, o primeiro equilíbrio se move para a direita.
Por outro lado, se aquecermos a dissolução de H2Co3, A solubilidade do CO diminuirá2 Na água porque é um gás, e o equilíbrio se moverá para a esquerda (haverá menos h2Co3). Semelhante será se tentarmos aplicar um vácuo: o CO2 Ele escapará, bem como as moléculas de água, que moveriam o equilíbrio para a esquerda novamente.
Sólido puro
O exposto acima permite chegar a uma conclusão: de uma solução de H2Co3 Não há como sintetizar esse ácido como um sólido puro através de um método convencional. No entanto, isso foi feito desde os anos 90 do século passado, começando por misturas sólidas de CO2 e h2QUALQUER.
Para esta mistura sólida co2-H2Ou a 50% é bombardeado com prótons (um tipo de radiação cósmica), de modo que nenhum dos dois componentes escape e a formação de H ocorre2Co3. Para esse fim, uma mistura de CHO também foi usada3OH-CO2 (Lembre-se de α-h2Co3).
Outro método é fazer o mesmo, mas diretamente usando gelo seco, nada mais.
Dos três métodos, os cientistas da NASA poderiam chegar a uma conclusão: o ácido carbônico puro, sólido ou gasoso, pode existir no sorvete de Júpiter, nas geleiras marcianas e nos cometas, onde essas misturas sólidas são constantemente irradiadas para raios cósmicos.
Pode servir a você: pipeta volumétrica: características, usos, calibração e errosFormulários
O próprio ácido carbônico é um composto sem qualquer utilidade. De suas soluções, no entanto, você pode preparar soluções de amortecimento com base nos pares da HCO3-/Co32- ou h2Co3/HCO3-.
Graças a essas soluções e à ação da enzima carbônica de anidrase, presente nos glóbulos vermelhos, o CO2 Produzido em respiração pode ser transportado no sangue para os pulmões, onde finalmente é liberado para ser exalado fora do nosso corpo.
O bubjueo do co2 Aproveite a sensação de bebidas da sensação agradável e característica que eles deixam na garganta ao beber.
Além disso, a presença de H2Co3 Tem importância geológica na formação de estalactites de calcário, pois os dissolve lentamente até que eles originem seus acabamentos pontiagudos.
E, por outro lado, suas soluções podem ser usadas para preparar alguns bicarbonatos de metal; Embora seja mais lucrativo e fácil de usar um sal de bicarbonato (Nahco3, por exemplo).
Riscos
O ácido carbônico tem uma vida tão pequena em condições normais (eles estimam que cerca de 300 nanossegundos), o que é praticamente inofensivo ao meio ambiente e aos seres vivos. No entanto, como afirmado anteriormente, isso não implica que não possa gerar uma mudança preocupante no pH da água do oceano, afetando a fauna marinha.
Por outro lado, o verdadeiro "risco" está na ingestão de água gasificada, já que a quantidade de CO2 dissolvido neles é muito maior do que na água normal. No entanto, e novamente, não há estudos que demonstraram que a bebida gastificada representa um risco mortal; Se você o recomendar para rapidamente e combate a indigestão.
O único efeito negativo observado naqueles que bebem essa água é a sensação de plenitude, já que seus estômagos estão cheios de gases. Fora disso (para não mencionar os refrigerantes, pois eles são compostos por muito mais do que apenas ácido carbônico), pode -se dizer que esse composto não é tóxico.
Referências
- Dia, r., & Underwood, um. (1989). Química analítica quantitativa (quinta ed.). Pearson Prentice Hall.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). ÁCIDO CARBÓNICO. Recuperado de: em.Wikipedia.org
- Danielle Reid. (2019). Ácido carbônico: Formação, estrutura e vídeo da equação química. Estudar. Recuperado de: estudo.com
- Götz Bucher e Wolfram Sander. (2014). Esclarecendo a estrutura do ácido carbônico. Vol. 346, edição 6209, pp. 544-545. Doi: 10.1126/ciência.1260117
- Lynn Yarris. (22 de outubro de 2014). Novas idéias sobre ácido carbônico na água. Laboratório de Berkeley. Recuperado de: NewsCenter.lbl.Gov
- Claudia Hammond. (14 de setembro de 2015). A água com gás é muito ruim para você? Recuperado de: BBC.com
- Jürgen Bernard. (2014). Ácido carbônico sólido e gasoso. Instituto de Química Física. Universidade de Innsbruck.
- « Leis de transferência de calor, formas de transmissão, exemplos
- 15 benefícios de maçãs para saúde física e mental »

