Propriedades, usos, estruturas, riscos, riscos,

- 4228
- 101
- Dennis Heidenreich
Ele Cianeto de potássio É um composto inorgânico formado por um on potássio k+ e um íon cianeto CN-. Sua fórmula química é KCN. É um sólido branco cristalino, extremamente venenoso.
O KCN é muito solúvel em água e, ao dissolver, é hidrolisado formando ácido canífrico ou cianeto de hidrogênio HCN, que também é muito venenoso. O cianeto de potássio pode formar sais compostos com ouro e prata, por isso foi usado para extrair esses metais preciosos de certos minerais.
 Cianeto de potássio KCN sólido. Morienus (enviado por DE: Benutzer: Bxxxd de: wiki) [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikimedia Commons.
Cianeto de potássio KCN sólido. Morienus (enviado por DE: Benutzer: Bxxxd de: wiki) [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikimedia Commons. O KCN é usado para cobrir metais baratos com ouro e prata através de um processo eletroquímico, ou seja, um método no qual uma corrente elétrica é passada através de uma solução que contém um sal composto de metal precioso, cianeto e potássio.
O cianeto de potássio porque contém cianeto deve ser manipulado com grande cautela, com implementos adequados. Nunca deve ser descartado para o meio ambiente, porque também é muito tóxico para a maioria dos animais e plantas.
No entanto, métodos que usam algas comuns estão sendo estudados para remover o cianeto de potássio de água contaminado com baixas concentrações deste.
[TOC]
Estrutura
KCN é um composto iônico formado por um cátion de potássio k+ e um ânion cianeto CN-. Nisso, o átomo de carbono está ligado ao átomo de nitrogênio através de uma ligação covalente tripla.
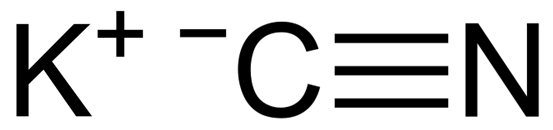 Estrutura química de cianeto de potássio KCN. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Estrutura química de cianeto de potássio KCN. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Em sólido cianeto de potássio, o ânion CN- Pode girar livremente pelo que se comporta como um ânion esférico, como conseqüência o cristal KCN tem uma estrutura cúbica semelhante à do cloreto de potássio KCL.
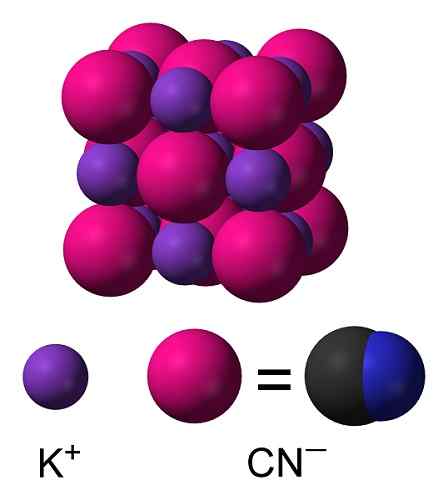 Estrutura cristalina KCN. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura cristalina KCN. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
- Cianeto de potássio
- Cianeto de potássio
- Cianopotasio
Propriedades
Estado físico
Sólido cristalino branco. Cristais cúbicos.
Peso molecular
65.116 g/mol.
Ponto de fusão
634,5 ° C
Pode atendê -lo: sulfato de alumínio (Al2 (SO4) 3)Ponto de ebulição
1625 ° C.
Densidade
1,55 g/cm3 A 20 ° C.
Solubilidade
Muito solúvel em água: 716 g/L a 25 ° C e 100 g/100 ml de água a 80 ° C. Pequeno solúvel em metanol: 4,91 g/100 g de metanol a 19,5 ° C. Muito pouco solúvel em etanol: 0,57 g/100 g de etanol a 19,5 ° C.
ph
Uma solução aquosa de 6,5 g de KCN em 1 L de água tem um pH de 11,0.
Constante de hidrólise
KCN é muito solúvel em água. Quando o íon cianeto CN é gratuito- que leva um próton h+ de água para formar o ácido canífrico HCN e liberar um íon OH-:
Cn- + H2O → hcn + oh-
A constante de hidrólise indica a tendência com a qual a reação é realizada.
Kh = 2,54 x 10-5
As soluções aquosas da KCN liberam o ambiente de cianeto de hidrogênio HCN quando aquecem 80 ° C.
Propriedades quimicas
Não é inflamável, mas quando o KCN sólido é aquecido até que sua decomposição emite cianeto de hidrogênio HCN muito tóxico, os óxidos de nitrogênio nãox, Óxido de K -Potássio2O e monóxido de carbono.
O KCN reage com sais de ouro formando aurocianuro kau (CN)2 e potássio auricianuro kau (CN)4. Estes são complexos sais incolores. Com o Silver Metal AG, o KCN forma o potássio argentocianeto kag (CN)2.
O íon cianeto KCN reage com certos compostos orgânicos que têm halogênio (como cloro ou bromo) e ocupa o lugar destes. Por exemplo, ele reage com ácido bromoacético para dar ácido cianoacético.
Outras propriedades
É higroscópico, absorve a umidade do meio ambiente.
Tem um cheiro suave de amêndoas amargas, mas isso não é detectado por todas as pessoas.
Obtenção
O KCN é preparado pela reação de hidróxido de potássio Koh em solução aquosa com cianeto de hidrogênio HCN. O ferrocianeto de potássio K também é obtido pelo aquecimento4Fé (CN)6:
K4Fé (CN)6 → 4 kcn + 2 c + n2↑ + fé
Use em eletrodo de metal
É usado no processo de cobrir pequenos metais valiosos com ouro e prata. É um processo eletrolítico, ou seja, a eletricidade é passada através de uma solução aquosa com sais apropriados.
Pode servir a você: Trioxide de enxofre (SO3): estrutura, propriedades, riscos, usosPrata
O potássio argentocianeto kag (CN) é usado2 Para revestir com metais mais baratos (AG).
Estes são colocados em uma solução aquosa de Kag de potássio (CN)2, Onde o ânodo ou pólo positivo é uma barra de prata pura (AG) e o cátodo ou pólo negativo é o metal barato que deseja revestir de prata.
À medida que uma corrente elétrica passa pela solução, a prata é depositada no outro metal. Quando os sais de cianeto são usados, a camada de prata é depositada de maneira mais fina, mais compacta e aderente do que em soluções de outros compostos.
 Alguns itens de jóias são cobertos com prata usando sais KCN. Autor: Stocksnap. Fonte: Pixabay.
Alguns itens de jóias são cobertos com prata usando sais KCN. Autor: Stocksnap. Fonte: Pixabay. Ouro
Da mesma forma, no caso de ouro (Au), o aurocianeto de potássio KAU (CN)2 e potássio auricianuro kau (CN)4 Outros metais são usados para marrom eletroliticamente.
 Conectores elétricos revestidos com ouro possivelmente usando sais KCN. CJP24 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Conectores elétricos revestidos com ouro possivelmente usando sais KCN. CJP24 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Outros usos
Alguns outros usos do cianeto de potássio são mencionados abaixo.
- Para o processo industrial de endurecer o aço nitratório (adição de nitrogênio).
- Para limpeza de metal.
- Nos processos de impressão e fotografia.
- Anteriormente, era usado para a extração de ouro e prata dos minerais que os contêm, mas depois foi substituído pelo cianeto de nacn de sódio que é mais barato, embora igualmente tóxico.
- Como inseticida para a fumigação de árvores, navios, vagões e armazéns.
- Como reagente na química analítica, isto é, fazer uma análise química.
- Para preparar outros compostos químicos, como corantes e corantes.
 Extração de ouro na África do Sul em 1903 usando o KCN o que era na poluição mortal do ambiente circundante. Argyll, John Douglas Sutherland Campbell, duque de, 1845-1914; Creswicke, Louis [sem restrições]. Fonte: Wikimedia Commons.
Extração de ouro na África do Sul em 1903 usando o KCN o que era na poluição mortal do ambiente circundante. Argyll, John Douglas Sutherland Campbell, duque de, 1845-1914; Creswicke, Louis [sem restrições]. Fonte: Wikimedia Commons. Riscos
KCN é um composto muito venenoso para animais e a maioria das plantas e microorganismos. É classificado como super tóxico. Ainda é letal em quantidades muito pequenas.
Pode atendê -lo: cloreto de níquel (nicl2): estrutura, propriedades, obtenção, usosSeu efeito prejudicial pode ocorrer por inalação, contato com a pele ou olhos ou ingestão. Inibe muitos processos metabólicos, especialmente proteínas sanguíneas que participam do transporte de oxigênio, como a hemoglobina.
Afeta os órgãos ou sistemas mais sensíveis à falta de oxigênio, como o sistema nervoso central (cérebro), o sistema cardiovascular (vasos cardíacos e sanguíneos) e pulmões.
 O cianeto de potássio é um veneno. Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay.
O cianeto de potássio é um veneno. Autor: Clker-Free-Vector-Imagens. Fonte: Pixabay. Mecanismo de ação
O KCN interfere na capacidade do corpo de usar oxigênio.
O ION CIANIDO CN- do KCN tem uma grande afinidade pela fé férrica3+, O que significa que quando o cianeto o absorve reage rapidamente com fé3+ Sangue e tecidos.
Dessa maneira, evita a respiração das células, que entram em um estado de falta de oxigênio, porque, embora tentem respirar, não podem usá -lo.
Ocorre então um estado transitório de Hipperapnea (suspensão respiratória) e dor de cabeça e, finalmente, a morte por parada respiratória.
Riscos adicionais
Ao aquecer, produz gases muito tóxicos, como HCN, óxidos de nitrogêniox, Óxido de K -Potássio2O e monóxido de carbono.
Após contato com a umidade do HCN que é altamente inflamável e muito tóxico.
O KCN também é muito venenoso para organismos aquáticos. Nunca deve ser descartado para o meio ambiente, pois pode ocorrer poluição da água onde eles bebem animais e habitam peixes.
No entanto, existem bactérias que produzem cianeto, como Chromobacterium violaceum e algumas espécies de Pseudomonas.
Estudos recentes
Certos pesquisadores descobriram que as algas verdes Chlorella vulgaris Pode ser usado para tratar águas contaminadas com cianeto de potássio KCN em baixas concentrações.
As algas foram capazes de remover com eficiência o KCN, porque isso em baixas quantidades estimulou o crescimento das algas, uma vez que ativou um mecanismo interno para resistir à toxicidade do KCN.
Isso significa que as algas Chlorella vulgaris Ele tem o potencial de remover o cianeto e que um método eficaz para o tratamento biológico da contaminação por cianeto pode ser projetado com isso.
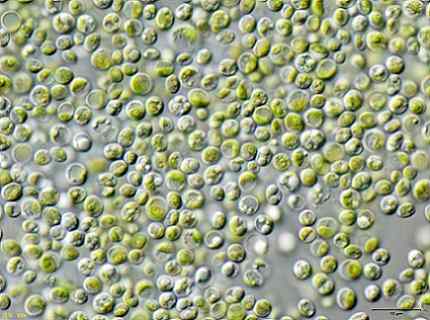 Imagem de algas Chlorella vulgaris observado em um microscópio. JA: Usuário: Neon / Usuário: Neon_Ja [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Imagem de algas Chlorella vulgaris observado em um microscópio. JA: Usuário: Neon / Usuário: Neon_Ja [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Cianeto de potássio. Centro Nacional de Informações sobre Biotecnologia. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Coppock, r.C. (2009). Ameaças à vida selvagem por agentes de guerra química. No Manual de Toxicologia de Agentes de Guerra Química. Recuperado de cientedirect.com.
- Liu, q. (2017). Avaliação da remoção do cianeto de potássio e sua toxicidade em algas verdes (Chlorella vulgaris). Bull Environment Contam Toxicol. 2018; 100 (2): 228-233. NCBI se recuperou.Nlm.NIH.Gov.
- O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH). (2011). CIANIDO DE POTÁSSIO: Agente sistêmico. CDC recuperado.Gov.
- Alvarado, l.J. et al. (2014). Descoberta, estrutura e função do riboswitch. Síntese de uracil. Em métodos em enzimologia. Recuperado de cientedirect.com.
- « Estrutura do tripolifosfato de sódio (Na5p3310), propriedades, usos, impacto, impacto
- Porque estou com muito sono? 9 causas e soluções »

