Células eletroquímicas

- 4923
- 425
- Melvin Mueller
O que são células eletroquímicas?
As células eletroquímicas São dispositivos em que as reações químicas passam onde a energia química é transformada em eletricidade ou vice -versa. Essas células compõem o coração da eletroquímica, sendo a alma a troca potencial de elétrons que podem ocorrer, espontâneos ou não espontaneamente, entre duas espécies químicas.
Uma das duas espécies oxida, perde os elétrons, enquanto a outra é reduzida pela conquista dos elétrons cedidos. Geralmente, a espécie reduzida é um cátion metálico em solução, que ganha eletricamente acaba sendo eletricamente em um eletrodo feito do mesmo metal. Por outro lado, as espécies que oxidam é um metal, tornando -se cátio.
 Diagrama de células eletroquímicas de Daniel. Fonte: Rechua [CC por (https: // CreativeCommons.Org/licenças/por/3.0)]
Diagrama de células eletroquímicas de Daniel. Fonte: Rechua [CC por (https: // CreativeCommons.Org/licenças/por/3.0)] Por exemplo, a imagem superior representa a célula de Daniel: a mais simples de todas as células eletroquímicas. O eletrodo metálico de zinco é oxidado, liberando cátions Zn2+ para o ambiente aquoso. Isso ocorre no recipiente de ZNSO4 da esquerda.
À direita, a solução contendo CuO4 É reduzido, transformando cátions cu2+ Em cobre metálico que é depositado no eletrodo de cobre. Durante o desenvolvimento dessa reação, os elétrons viajam um circuito externo ativando seus mecanismos; E, portanto, fornecendo eletricidade para a operação de um equipamento.
Componentes celulares eletroquímicos
Eletrodos
Nas células eletroquímicas são geradas ou consumidas. Para garantir um fluxo adequado de elétrons, deve haver materiais que sejam bons condutores de eletricidade. É aqui que os eletrodos e circuito externo vêm, fornecido com fiação de cobre, prata ou ouro.
Os eletrodos são os materiais que fornecem a superfície onde as reações em células eletroquímicas serão desenvolvidas. Existem dois tipos de acordo com a reação que ocorre neles:
- Ânodo, eletrodo onde ocorre a oxidação.
- Cátodo, eletrodo onde a redução ocorre.
Os eletrodos podem ser feitos de um material de reação, como no caso da célula de Daniel (zinco e cobre); ou, de um material inerte, como é o caso quando são feitos de platina ou grafite.
Os elétrons atribuídos pelo ânodo devem chegar ao cátodo; Mas não através de uma solução, mas viajando um cabo metálico que se junta aos dois eletrodos a um circuito externo.
Dissolução eletrolítica
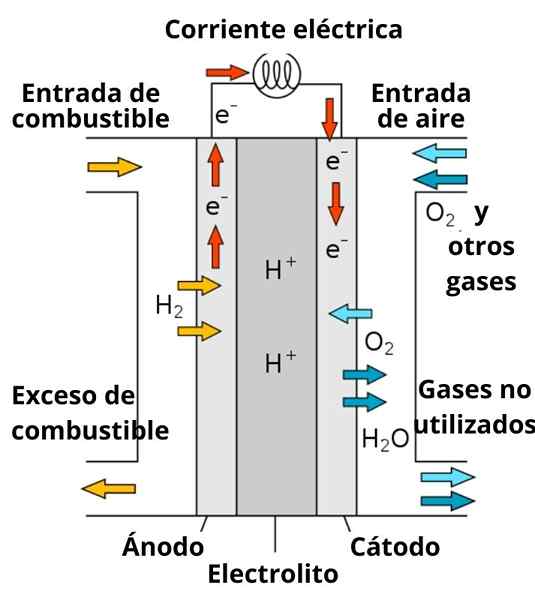 Esquema de um prótons Bateria de combustível condutor
Esquema de um prótons Bateria de combustível condutor A dissolução que envolve os eletrodos também desempenha um papel importante, pois é enriquecido com eletrólitos fortes; como: kcl, kno3, NaCl, etc. Esses íons favorecem, em certa medida.
A água do mar, por exemplo, leva a eletricidade muito melhor do que a água destilada, com menor concentração de íons. É por isso que as células eletroquímicas têm uma solução de eletrólitos fortes entre seus componentes.
Ponte salina
Os íons da solução começam a envolver os eletrodos que causam uma polarização das cargas. A dissolução ao redor do cátodo começa a cobrar negativamente, à medida que os cátions estão sendo reduzidos; No caso da célula de Daniel, CUs cátions2+ Depositando como um cobre metálico no cátodo. Assim, há um déficit de cargas positivas.
É aqui que a ponte salina intervém para equilibrar as cargas e impedir que os eletrodos sejam polarizados. Ao lado ou compartimento dos cátions cátodo da ponte salina migrarão, ou k+ ou Zn2+, Para suplantar o CU2+ consumido. Enquanto isso, da ponte salina migrará ânions não3- Em direção ao compartimento do ânodo, para neutralizar a crescente concentração de cátions de Zn2+.
Pode servir a você: dicromato de potássio: fórmula, propriedades, riscos e usosA ponte salina é composta por uma solução de sais saturada, com as extremidades cobertas por um gel de íons permeável, mas à prova d'água para água.
Tipos de células eletroquímicas e como elas funcionam
A maneira pela qual uma célula eletroquímica funciona depende do tipo que é. Existem fundamentalmente dois tipos: galvânico (ou voltaico) e eletrolítico
Galvânica
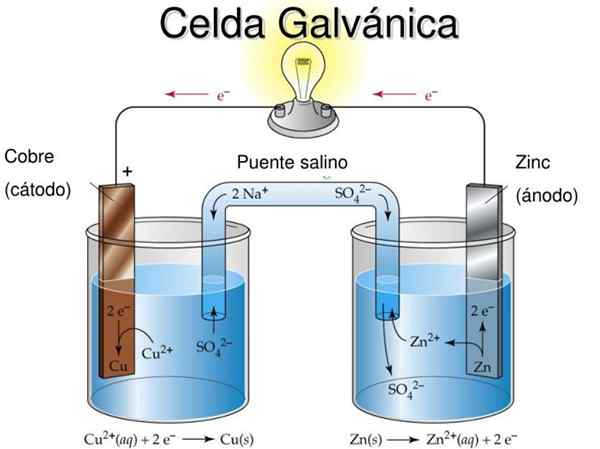
A célula de Daniel é um exemplo de célula eletroquímica galvânica. Neles, as reações ocorrem espontaneamente e o potencial da bateria é positivo; Quanto maior o potencial, maior a eletricidade que fornecerá a célula.
As baterias ou baterias são células galvânicas com precisão: o potencial químico entre os dois eletrodos é transformado em energia elétrica quando um circuito externo intervém que as conecta. Assim, os elétrons migram do ânodo, acendem o equipamento ao qual a bateria está conectada e são devolvidos diretamente ao cátodo.
Eletrolítico
As células eletrolíticas são aquelas cujas reações não ocorrem espontaneamente, a menos que sejam fornecidas por energia elétrica de uma fonte externa. Aqui ocorre o fenômeno oposto: a eletricidade permite que reações químicas não espontâneas desenvolvam.
Uma das reações mais conhecidas e valiosas que ocorre dentro desse tipo de célula é a eletrólise.
As baterias recarregáveis são exemplos de eletrolíticos e, ao mesmo tempo, galvânico: são recarregadas para reverter suas reações químicas e restabelecer as condições iniciais para reutilizar novamente.
Exemplos
Celular de Daniel
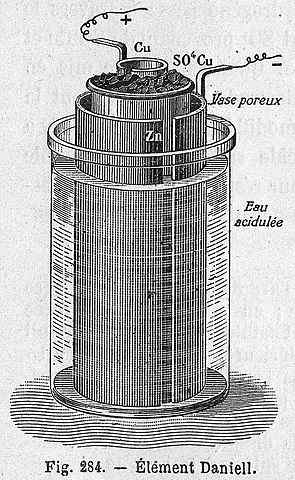 Esquema celular de Daniel
Esquema celular de Daniel A equação química a seguir corresponde à reação da célula de Daniel, onde o zinco e o cobre participam:
Pode atendê -lo: alugar halogenuros: propriedades, obtenção, exemplosZn (s) + Cu2+(aq) → Zn2+(aq) + cu (s)
Mas cátions CU2+ e Zn2+ Eles não estão sozinhos, mas acompanhados pelos ânions SO42-. Esta célula pode ser representada da seguinte maneira:
Zn | ZNSO4 | | CUSO4 | Cu
A célula de Daniel pode ser construída em qualquer laboratório, sendo muito recorrente como uma prática na introdução da eletroquímica. Como cu2+ É depositado como Cu, a cor azul da solução CUSO4 Será perdido.
Célula de platina e hidrogênio
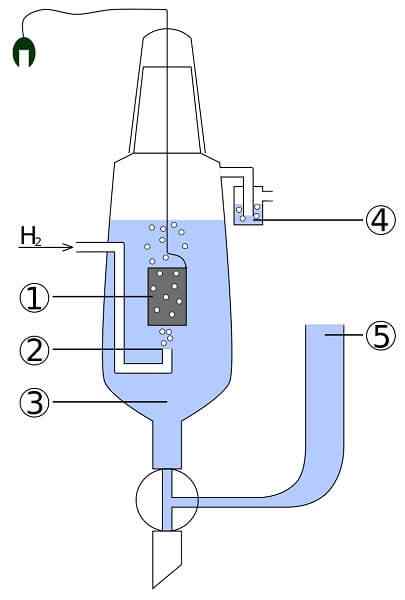 Esquema de uma célula de platina e hidrogênio: 1. 2 eletrodo de platina. Gas de hidrogênio 3. Solução ácida 4. Hidroseal 5. Depósito da União
Esquema de uma célula de platina e hidrogênio: 1. 2 eletrodo de platina. Gas de hidrogênio 3. Solução ácida 4. Hidroseal 5. Depósito da União Imagine uma célula que consome hidrogênio gasoso, produz prata de metal e, ao mesmo tempo, leva eletricidade. Esta é a célula de platina e hidrogênio, e sua reação geral é a seguinte:
2AGCL (s) + h2(g) → 2ag (s) + 2h+ + 2cl-
Aqui no compartimento do ânodo, temos um eletrodo de platina inerte, submerso na água e para o qual o hidrogênio do gás é bombeado. O h2 Seja oxidado para H+ e produz seus elétrons para o precipitado leitosa da AGCL no compartimento do cátodo com um eletrodo de prata de metal. AGCL será reduzido nesta prata e a massa do eletrodo aumentará.
Esta célula pode ser representada como:
Pt, h2 | H+ | | Cl-, AGCL | AG
Célula Downs
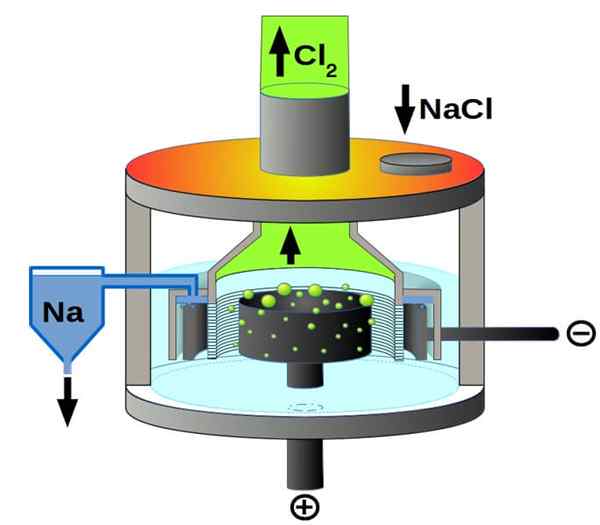 Esquema de células Downs para eletrólise de cloreto de sódio. Fonte: PChemiker, CC BY-SA 4.0, via Wikimedia Commons
Esquema de células Downs para eletrólise de cloreto de sódio. Fonte: PChemiker, CC BY-SA 4.0, via Wikimedia Commons E, finalmente, entre as células eletrolíticas, temos o cloreto de sódio fundido, mais conhecido como célula Downs. Aqui, a eletricidade é feita para percorrer os eletrodos um volume de NaCl fundido e, portanto, se origina neles as seguintes reações:
2º+(l) + 2e- → 2NA (s) (cátodo)
2cl-(L) → Cl2(g) + 2e- (ânodo)
2NACL (L) → 2NA (S) + CL2(g) (reação global)
Assim, graças à eletricidade e ao cloreto de sódio, o sódio metálico e o gás de cloro podem ser preparados.

