Cátion de treinamento, diferenças com ânion e exemplos

- 829
- 7
- Pete Wuckert
A cátion É uma espécie química que tem uma carga positiva. Os dois tipos de íons existentes são para o ânion. Sua carga é o produto de uma deficiência de elétrons no átomo, o que faz com que os prótons principais exerçam uma maior atração. Para cada elétron que perde um átomo neutro, a carga positiva é aumentada em uma unidade.
Se um átomo perder um elétron e, portanto, o número de prótons é maior que um, sua carga positiva será +1; Se você perder dois elétrons, a carga será +2 e assim por diante. Quando um cátion tem uma carga de +1, diz -se que é monovalente; Por outro lado, se a carga é maior que +1, diz -se que o cátion é versátil.
 Hidronio, um dos cátions mais simples. Fonte: Gabriel Bolívar.
Hidronio, um dos cátions mais simples. Fonte: Gabriel Bolívar. Na imagem superior, é mostrado ao cátion h3QUALQUER+, chamado hidronio íon. Como pode ser visto, mal tem uma carga de +1, de acordo com um cátion monovalente.
Os cátions são espécies importantes, uma vez que exercem uma força eletrostática com seu ambiente e as moléculas ao redor. Eles têm uma alta interação com água, líquido que os hidrata e transporta em solos úmidos e depois atinge as raízes das plantas e são usadas para suas funções fisiológicas.
[TOC]
Como é formado um cátion?
Foi mencionado que quando um átomo perde um elétron, seu maior número de prótons, em relação aos elétrons, exerce uma força de atração que se traduz em uma carga positiva. Mas como a perda de elétrons pode ocorrer? A resposta depende da transformação que ocorreu em reações químicas.
Deve -se notar que a presença de um átomo com carga positiva não implica necessariamente a formação de um cátion. Para que possa ser considerado como tal, não deve haver um átomo com uma carga formal negativa que neutralize. Caso contrário, haveria atração e repulsão dentro do mesmo composto e seria neutro.
Pode servir a você: sulfato de cálcio (case4): estrutura química, propriedades, usosCobranças formais e mais links
Átomos eletronegativos atraem os elétrons de suas ligações covalentes para eles. Embora os elétrons sejam compartilhados igualmente, há um ponto em que eles terão parcialmente menos elétrons do que em sua configuração basal; Isto é, o de seus átomos livres sem estar ligado a outros elementos.
Em seguida, esses átomos eletronegativos começarão a experimentar uma deficiência de elétrons e, com ela, os prótons de seus núcleos exercerão uma força de maior atração; A carga formal positiva nasce. Se houver apenas uma carga formal positiva, o composto manifestará uma carga iônica positiva global; Assim o cátion nasceu.
O átomo de oxigênio do cátion h3QUALQUER+ É um exemplo fiel do acima. Por ter três ligações O-H, uma a mais do que na molécula de água (H-O-H), experimenta a perda de um elétron em relação ao seu estado basal. Os cálculos das cargas formais permitem determinar quando isso acontece.
Se a formação de outro O-H for assumida por um momento, o cátion divalente será obtido4QUALQUER2+. Observe que a carga divalente no topo do cátion está escrita da seguinte forma: o número seguiu o símbolo '+'; Da mesma maneira, os ânions são prosseguidos.
Oxidação
Metais são formadores de cátions por excelência. No entanto, nem todos podem formar ligações covalentes (ou pelo menos puramente covalente). Em vez disso, eles perdem elétrons para estabelecer títulos iônicos: uma carga positiva atrai um negativo, unido por forças físicas.
Portanto, os metais perdem elétrons para passar de M para Mn+, onde n Geralmente é igual ao número do seu grupo na tabela periódica; embora n Você pode tomar vários valores inteiros, o que ocorre especialmente com metais de transição. Esta perda de elétrons é realizada em um tipo de reação química chamada oxidação.
Pode atendê -lo: álcool terciário: estrutura, propriedades, exemplosOs metais oxidam, perdem um elétron, o número de prótons de seus átomos excede o dos elétrons e, consequentemente, exibe uma carga positiva. Para que haja oxidação, deve haver um agente oxidante, que reduz ou ganha elétrons perdidos por metais. Oxigênio é o agente oxidante mais conhecido de todos.
Diferenças com ânion
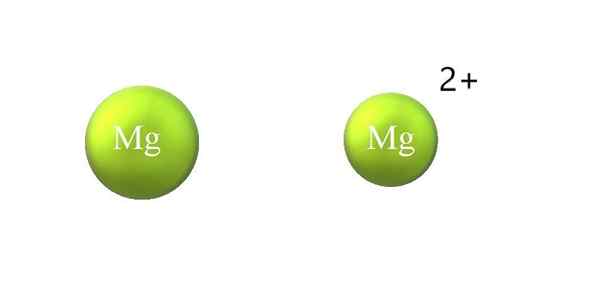 Contração do raio atômico em um cátion. Fonte: Gabriel Bolívar.
Contração do raio atômico em um cátion. Fonte: Gabriel Bolívar. Abaixo estão as diferenças entre um cátion e ânion:
-O cátion geral é menor que o ânion. A imagem superior mostra como o raio atômico do MG é reduzido pela perda de dois elétrons e se tornando o cátion Mg2+; O oposto ocorre com os ânions: eles se tornam mais volumosos.
-Tem mais prótons do que elétrons, enquanto o ânion tem mais elétrons do que prótons.
-Sendo menor, sua densidade de carga é maior e, portanto, possui maior poder de polarização; isto é, deforma as nuvens eletrônicas de átomos vizinhos.
-Um cátion se move na mesma direção que o do campo elétrico aplicado, enquanto o ânion o faz na direção oposta.
Exemplos dos cátions mais comuns
Monoatômico
Cátions monoatômicos vêm principalmente de metais (exceto por certas exceções, como H+). Do resto, é extremamente raro considerar um cátion derivado de um elemento não -metálico.
Veremos que muitos deles são DIs ou versáteis e que as magnitudes de suas cargas concordam com o número de seus grupos na tabela periódica.
Pode atendê-lo: ribulosa-1,5-bifosfato (rubp): características, carbolixação-Li+
-N / D+
-K+
-Rb+
-Cs+
-Fr+
-AG+
Todos têm em comum a carga '1+', que está escrita sem colocar o número, e também vem do grupo 1: metais alcalinos. Além disso, há o cátion AG+, Um dos metais de transição mais comuns.
-Ser2+
-Mg2+
-AC2+
-Senhor2+
-BA2+
-Ra2+
Esses cátions divalentes derivam de seus respectivos metais pertencentes ao Grupo 2: Metais Alcalineriores.
-Para o3+
-Ga3+
-Em3+
-Tl3+
-NH3+
Cátions trivalentes do grupo Boro.
Até agora, os exemplos foram caracterizados por ter uma única valência ou carregamento. Outros cátions exibem mais de uma valência ou estado de oxidação positiva:
-Sn2+
-Sn4+ (lata)
-Co2+
-Co3+ (cobalto)
-Au+
-Au3+ (ouro)
-Fé2+
-Fé3+ (ferro)
E outros metais, como o manganês, ainda podem ter muito mais valências:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Quanto maior a carga, menor e polarização serão o cátion.
Poliatômico
Sem entrar em química orgânica, existem cátions inorgânicos e polilâmicos que são muito comuns na vida cotidiana; tais como:
-H3QUALQUER+ (Hydronio, já mencionado).
-NH4+ (Amônio).
-NÃO2+ (Nitronio, presente nos processos de nitração).
-Ph4+ (Fosfônio).
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (5 de maio de 2019). Definição e exemplo cátion. Recuperado de: pensamento.com
- Wyman Elizabeth. (2019). Cátion: definição e exemplo. Estudar. Recuperado de: estudo.com
- Bobos. (2019). INS positivos e negativos: cátions e ânions. Recuperado de: manequins.com
- Wikipedia. (2019). Cátion. Recuperado de: é.Wikipedia.org
- « Estrutura de anisol, propriedades, nomenclatura, riscos e usos
- Origem arqueolítica, características, clima, flora e fauna »

