Estrutura de carbonato de lítio (LI2CO3), propriedades, usos

- 669
- 111
- Alfred Kub
Ele Carbonato de lítio É um sólido inorgânico formado por dois lítio li+ e um ânion carbonato Co32-. Sua fórmula química é Li2Co3. O li2Co3 É um sólido cristalino branco que pode ser obtido pela reação entre hidróxido de lítio e dióxido de carbono.
O carbonato de lítio tem um ponto de fusão muito alto, por isso é usado na preparação de vidro, cerâmica e porcelana. Possui usos muito variados, como baterias recarregáveis de lítio, na preparação de outros compostos de lítio, eletrodos de soldagem e em pinturas e vernizes.
 Carbonato de lítio li2Co3 sólido. Foto tirada por W: Usuário: Walkerma em junho de 2005. Fonte: Wikimedia Commons.
Carbonato de lítio li2Co3 sólido. Foto tirada por W: Usuário: Walkerma em junho de 2005. Fonte: Wikimedia Commons. Li também é usado2Co3 Nas misturas de cimento para alcançar uma configuração rápida e produção de alumínio.
Um de seus usos mais importantes está no tratamento de algumas doenças mentais, como depressão e comportamentos excessivamente agressivos, entre outras condições.
No entanto, seu uso como medicamento deve ser devidamente controlado por médicos especialistas, porque as pessoas tratadas com Li2Co3 Eles podem sofrer efeitos prejudiciais para a saúde, como hipotireoidismo (função reduzida da glândula tireóide).
[TOC]
Estrutura
Carbonato de lítio é composto por dois lítio li+ e um ânion carbonato Co32-.
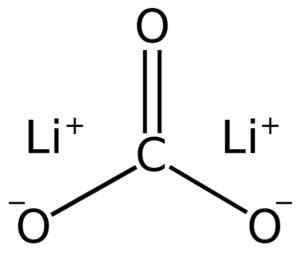 Estrutura de carbonato de lítio lii2Co3. Adrian Hands [domínio público]. Fonte: Wikimedia Commons.
Estrutura de carbonato de lítio lii2Co3. Adrian Hands [domínio público]. Fonte: Wikimedia Commons. Configuração eletrônica de lítio no estado de oxidação +1 é 1s2 2s0, Bem, ele perdeu o elétron da última camada, sendo mais estável. O ION CARBOLATE CO32- Tem uma estrutura plana.
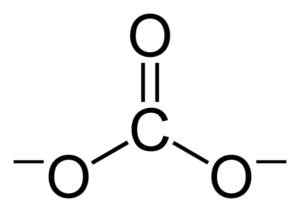 Estrutura plana do Coal Ion Co32-. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura plana do Coal Ion Co32-. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Cargas negativas são distribuídas igualmente entre os três átomos de oxigênio do Coal Ion Co32-.
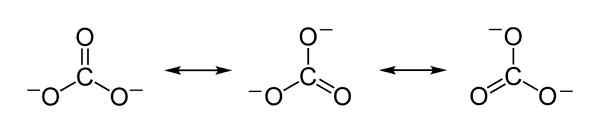 Estruturas de ressonância teórica do carbonato ION CO32- que servem para explicar a distribuição equitativa de cargas negativas entre os 3 átomos de oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estruturas de ressonância teórica do carbonato ION CO32- que servem para explicar a distribuição equitativa de cargas negativas entre os 3 átomos de oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
-Carbonato de lítio
-Dilitio Carbonato
Propriedades físicas
Estado físico
Sólido branco cristalino de estrutura monoclínica
Peso molecular
73,9 g/mol
Ponto de fusão
723 ºC
Decomposição
Se decompõe a 1300 ºC.
Densidade
2.11 g/cm3
Solubilidade
Pouco solúvel em água: 1,31 % em peso a 20 ºC. Sua solubilidade de água diminui à medida que a temperatura aumenta. É solúvel em ácidos diluídos. É insolúvel em álcool e acetona.
Pode servir a você: óxido de bário (BAO): estrutura, propriedades, usos, riscosph
As soluções de água são alcalinas, elas têm um pH maior que 7.
Propriedades quimicas
O li2Co3 Está hidrolisado em solução aquosa, gerando uma solução básica. A pequena proporção do composto que é solubilizado em água deixa o co -isão carbonato32-.
O ânion carbonato co32- Livre em solução aquosa leva um próton para formar o ânion Bicarbonato HCO3-, Como pode ser visto na seguinte reação:
Co32- + H2O → HCO3- + Oh-
A presença de íons oh- É o que torna a solução básica.
Propriedades biológicas
Nos tecidos animais e humanos, existem normalmente traços de lítio, mas até o momento nenhum papel fisiológico natural desse íon é conhecido.
No organismo humano, o li2Co3 ingerido como medicação, atua em uma variedade de mecanismos de sinalização em neurônios e outras células. Isso resulta da substituição de cátions como sódio e potássio.
A incorporação do íon de lítio na estrutura da membrana celular pode alterar a resposta a hormônios e acoplamento celular com processos de energia.
Dessa maneira.
Através da modificação da maneira como as células funcionam2Co3 Você pode agir sobre os mecanismos de comunicação dos neurônios no cérebro.
Obtenção
O li2Co3 Pode ser obtido pela reação de hidróxido de lítio com dióxido de carbono Co2, Como mostrado abaixo:
2 lioh + co2 → Li2Co3 + H2QUALQUER
Ocorre comercialmente de minerais que contêm lítio, como spodumen e lepidolito. Esses minerais são tratados em altas temperaturas com certos sais de sulfato ou com compostos alcalinos para obter sais de lítio.
Os sais de lítio obtidos são purificados com soluções de água ou ácido e depois são tratados com carbonatos para formar li2Co3.
No entanto, o li2Co3 Conseguido dessa maneira é contaminado com sulfatos ou cloretos de cálcio, magnésio, ferro, sódio, potássio, etc. Portanto, requer purificação subsequente.
Formulários
No tratamento de doenças mentais
É usado como antidepressivo, agente antimaníaco, no tratamento de comportamentos agressivos-impulsivos e para distúrbios bipolares (pessoas que mudam de humor repentinamente, sem causa, se tornando violentas).
Pode atendê -lo: 20 exemplos de sublimação química e características Alguns distúrbios agressivos-impulsivos podem ser tratados com li2Co3. Autor: Prawny. Fonte: Pixabay.
Alguns distúrbios agressivos-impulsivos podem ser tratados com li2Co3. Autor: Prawny. Fonte: Pixabay. Os médicos observaram que sua administração leva à diminuição da intensidade e frequência de períodos graves de depressão e episódios maníacos.
É usado sozinho, isto é, sem qualquer composto adicional, na terapia de manutenção da depressão unipolar e para transtorno esquizoecific. Também serve para aumentar o efeito antidepressivo de outros medicamentos.
Embora tenha sido usado para tratar crianças com sintomas aparentes de transtorno bipolar e hiperatividade com componentes neuróticos ou agressivos, não foi eficaz em todos os casos.
No tratamento de sintomas de outras doenças
É usado para reduzir a frequência de fortes dores de cabeça, recorrentes e crônicas.
É usado para reduzir a incidência de infecção em pacientes com neutropenia induzida por quimioterapia ou outros motivos. Neutropenia é a diminuição dos neutrófilos, um tipo de glóbulos brancos que ajudam a combater infecções no corpo.
Foi usado como inibidor da enzima da tireóide para o tratamento do hipertireoidismo, mas não é o tratamento preferido devido aos seus efeitos adversos.
Forma de administração
É usado na forma de comprimidos ou cápsulas LI2Co3. Também em comprimidos de liberação lenta com citrato de lítio. Li é preferido2Co3 Porque não irrite a garganta ao engoli -la, como acontece com outros sais de lítio.
 Autor: Pete Lyforth. Fonte: Pixabay.
Autor: Pete Lyforth. Fonte: Pixabay. Efeitos adversos
O li2Co3 Pode ter um efeito prejudicial na tireóide e nos rins, de modo que a função desses órgãos deve ser monitorada antes e durante o tratamento com este composto.
O li2Co3 Pode ser tóxico em concentrações muito próximas às empregadas em tratamentos médicos, portanto é necessária uma revisão contínua de seus valores séricos no sangue.
Sintomas de envenenamento por LI2Co3 São tremores, espasmos musculares, fraqueza muscular, diarréia, vômito, sonolência ou ataxia (deterioração da coordenação muscular), entre outros.
No início da Lirapy2Co3 Sintomas como tremores, dores de cabeça e náusea também podem ocorrer. Mas estes tendem a desaparecer com a contínua medicação.
Pode atendê -lo: HolmioA maioria das pessoas tratadas também pode desenvolver leucocitose (aumento do número de glóbulos brancos), mas isso é reversível.
Pessoas que estão sendo medicadas com li2Co3 Eles não devem lidar com veículos ou operar máquinas, porque diminui a coordenação física e a capacidade de realizar atividades que precisam ser alertas.
Casos em que não deve ser administrado
Não deve ser usado em crianças menores de 12 anos, pois pode interferir na formação de ossos e sua densidade, pois altera as concentrações de um hormônio da tireóide. Também tende a ocupar o local de cálcio nos ossos.
Eles não devem ser tratados com li2Co3 Pessoas com doença cardiovascular, rins ou tireóide. Nem em pacientes gravemente desidratados.
Mulheres grávidas não devem ser administradas especialmente durante o primeiro trimestre da gravidez. O lítio atravessa a placenta e pode alcançar o feto facilmente com possíveis efeitos teratogênicos, ou seja, pode produzir anomalias ou malformações no bebê que está se formando.
Idosos que precisam de tratamento com li2Co3 Eles devem ser tratados com muito cuidado e com doses inferiores às dos jovens adultos, pois podem desenvolver doenças de hipotireoidismo.
Outros usos
O li2Co3 A alta pureza é amplamente utilizada na fabricação de baterias recarregáveis de lítio.
É usado em células de combustível de carbonato fundido.
É usado na fabricação de porcelana elétrica que é um tipo de porcelana isolante de eletricidade. Também é usado na produção de vidros em cerâmica.
 O li2Co3 É usado para fabricar porcelana elétrica, que é usada como isolante de eletricidade, por exemplo, em postes de energia elétrica. FIR0002 Flagstoffotos [at] Gmail.com Canon 20D + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.gnu.Org/licenças/licendas antigas/fdl-1.2.html)]. Fonte: Wikimedia Commons.
O li2Co3 É usado para fabricar porcelana elétrica, que é usada como isolante de eletricidade, por exemplo, em postes de energia elétrica. FIR0002 Flagstoffotos [at] Gmail.com Canon 20D + Tamron 28-75mm f/2.8 [GFDL 1.2 (http: // www.gnu.Org/licenças/licendas antigas/fdl-1.2.html)]. Fonte: Wikimedia Commons. Ele permite preparar cerâmica com baixo coeficiente de expansão, ou seja, que se expande muito pouco ao aumentar a temperatura, para que a cerâmica possa ser usada em um intervalo de temperatura mais alto.
Outros de seus usos são como catalisadores, na fabricação de outros compostos de lítio, como eletrodos de soldagem, em fórmulas de tinta luminescente, vernizes e corantes, bem como na produção eletrolítica de alumínio.
É útil para gerar uma configuração de cimento mais rápida e adiciona a cola de ladrilhos para que eles possam ser consertados em pouco tempo.
 Autor: Capri23Auto. Fonte: Pixabay.
Autor: Capri23Auto. Fonte: Pixabay. Referências
- Cai, w. et al. (2018). Remoção de So42- de li2Co3 por recristalização em NA2Co3. Cristais 2018, 8, 19. MDPI se recuperou.com.
- Gadikota, g. (2017). Conectando as alterações morfológicas e estruturais de cristal durante a conversão de monohidrato de hidróxido de lítio em carbonato de lítio usando medições de espalhamento de raios-X em várias escalas. Minerais 2017, 7, 169. MDPI se recuperou.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Carbonato de lítio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Quarta edição. John Wiley & Sons.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Vch verlagsgellschaft mbh.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- « Exemplos de ângulos conjugados internos e externos, exercícios
- .Estrutura de ácido esteárico (CH3 (CH2) 16cooh), propriedades, usos »

