Calor de evaporação

- 4478
- 1134
- Terrell Stokes
 O calor da evaporação, ou vaporização, é aquele que sofre um produto químico para mudar o estado líquido para o gasoso
O calor da evaporação, ou vaporização, é aquele que sofre um produto químico para mudar o estado líquido para o gasoso O que é calor de evaporação?
Ele Calor de evaporação, Também chamado de calor de vaporização, é definido como a quantidade de calor que uma química pura absorve para evaporar, ou seja, sofrer uma mudança de estado do estado líquido para o estado a gás.
Ou seja, é o calor associado ao próximo processo de mudança de fase:
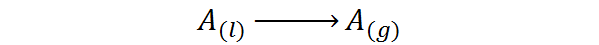
É um tipo de calor que não gera um aumento de temperatura, mas quebra as forças que mantêm as moléculas líquidas juntas. Dessa forma, é possível separar as moléculas uma da outra, liberando -as para a fase gasosa.
Fórmula e unidades
O calor da evaporação ou vaporização pode ser representado por meio do símbolo qVAP. É uma quantidade extensa, ou seja, depende da quantidade de substância.
Nesse sentido, pode ser calculado a partir da quantidade de substância e uma medida intensiva de calor de evaporação.
Quando a quantidade de substância é expressa na forma de uma massa, o calor latente de evaporação ou vaporização deve ser usado, lVAP, nesse caso, o calor da evaporação é expresso como:
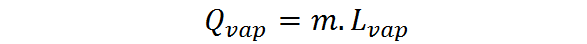
O calor latente de vaporização é uma quantidade intensiva e característica de cada substância. É uma medida mais ou menos direta de quão forte as interações intermoleculares são entre as partículas que compõem um líquido.
Por outro lado, o calor da vaporização também pode ser calculado a partir do número de toupeiras; nesse caso, o calor molar da vaporização é necessário, também chamado de entalpia de vaporização:
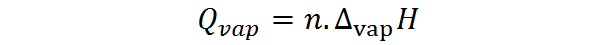
Onde n representa o número de moles e ∆VAPH é a entalpia da vaporização da substância. A entalpia de vaporização representa a quantidade de pressão constante necessária para evaporar um mol de uma substância.
Pode servir você: ácido de propanoUnidades de calor de evaporação
Sendo um tipo de calor, que é uma forma de energia, o calor da evaporação é expresso em unidades de energia. As unidades mais usadas são:
- Calorias (limão)
- Kilocalories (Kcal ou Lime)
- Jouls ou joules (j)
- Kilojouls ou Kilojulios (KJ), etc.
Por outro lado, o calor latente de evaporação (LVAP) É expresso em unidades de energia de massa. Por exemplo:
- cal/g
- Kcal/g
- KCAL/KG
- KJ/G
- kj/kg, etc.
Finalmente, entalpia de vaporização (∆VAPH) É expresso em unidades de energia em unidades de quantidade de matéria, geralmente toupeiras. Alguns exemplos são:
- cal/mol
- Kcal/mol
- J/mol
- KJ/mol, etc.
Como o calor da evaporação é calculado?
Como vimos há um momento, o calor da evaporação pode ser calculado a partir da massa ou número de moles e o calor latente de evaporação ou a entalpia de vaporização, respectivamente, respectivamente.
No entanto, essas quantidades geralmente são determinadas medindo experimentalmente a quantidade de calor necessária para evaporar uma certa massa de uma substância e depois limpar uma das duas equações anteriores.
Devido ao exposto, o comum não é que o calor da vaporização seja calculado, mas que é medido experimentalmente, no laboratório.
Por outro lado, como a entalpia como propriedade termodinâmica de um sistema é uma função de estado, isso pode ser calculado a partir de outras entalpias relacionadas a uma substância em um estado líquido com a mesma substância em um estado gasoso.
Por exemplo, a entalpia de vaporização pode ser calculada subtraindo a entalpia da sublimação, exceto a entalpia de fusão de uma substância. Então, essa entalpia e o número de toupeiras são usados para determinar o calor da evaporação da amostra.
Pode atendê -lo: policloreto de alumínio: estrutura, propriedades, obtenção, usoAplicações de calor de evaporação
Existem muitos campos nos quais o calor da evaporação é usado. De fato, em qualquer processo que envolva um produto químico que, ao mesmo tempo, está em um estado líquido e em outro em um estado gasoso, o calor da evaporação intervirá.
O calor da evaporação é sempre positivo, pois é sempre necessário absorver o calor para quebrar a união entre as moléculas que formam um líquido. A substância absorve esse calor do ambiente imediato, então eles perdem calor quando um líquido evapora.
Evaporação de calor e regulação da temperatura corporal
Este é o princípio da operação de sudorese como um sistema de regulação de temperatura corporal.
Quando suamos, a água do suor evapora na superfície da nossa pele. Como a pele está em contato direto com o suor, é aí que a água obtém o calor da evaporação.
Então, ao evaporar, a água do suor carrega consigo uma quantidade de calor da pele, que esfria, também resfriando o sangue que flui através dos capilares da pele e, finalmente, o interior do corpo.
Calor de evaporação na indústria
A energia é um dos maiores custos para muitos setores, e muitos deles precisam gastar energia para evaporar diferentes substâncias. Por esse motivo, é necessário calcular a quantidade de calor necessária para evaporar líquidos diferentes para calcular os custos operacionais.
Por exemplo, se uma empresa farmacêutica sintetizar um medicamento em uma solução alcoólica, provavelmente terá que evaporar e secar o produto para eliminar todo o álcool. O calor da evaporação nos permite determinar quanta energia será necessária para realizar isso.
Pode atendê -lo: ácido periádico (HIO4): o que é, estrutura, propriedades, usaFabricação de gelo em um trem
Antes da existência de eletricidade, os trens usavam calor de evaporação para congelar água e, assim, fazer gelo durante a viagem. O processo é semelhante ao suor e funciona da mesma maneira.
Na estação, o trem enganta uma bolsa de couro que contém água líquida. A bolsa não é perfeitamente hermética, então o exterior está umedecido. Durante a viagem, o ar evapora rapidamente a água da superfície da bolsa, absorvendo o calor da água líquida e resfriando -a, até o ponto de congelar.
Exemplos de aquecimentos de evaporação
A tabela a seguir contém aquecimentos latentes de vaporização ou evaporação para alguns produtos químicos comuns.
| Substância | Calor latente de vaporização (EUVAP/KJ.g-1) | Entalpia de vaporização (∆VAPH/KJ.mol-1) |
| Água (h2QUALQUER) | 2.260 | 40.657 |
| Etanol (cap3CH2OH) | 0,837 | 38.56 |
| Sulfeto de hidrogênio (H2S) | 0,6422 | 21.90 |
Referências
- Ehu.É (s. F.). Calor latente de vaporização de água. Retirado de sc.Ehu.é.
- Luz, g. (s. F.). Calor de vaporização. Retirado de materiais.Gelsonluz.com.
- Soler & Palau (2019). Calor latente: fusão e vaporização. Retirado de Solerpalau.com.
- Spiegato (2021). Qual é o calor da vaporização? Tirado de Spiegato.com.

