História do Bromo, estrutura, configuração eletrônica, propriedades, usa

- 2913
- 877
- Alfred Kub
Ele bromo É um elemento não -metálico que pertence ao grupo halogens, Grupo 17 (VIIa) da tabela periódica. Seu símbolo químico é o BR. É apresentado como uma molécula diatômica, cujos átomos são unidos por uma ligação covalente, de modo que a fórmula molecular é atribuída2.
Ao contrário do fluoreto e do cloro, o bromo em condições terrestres não é um gás, mas um líquido marrom avermelhado (imagem inferior). Está fumando e está junto com Mercúrio, os únicos elementos líquidos. Abaixo dele, o iodo, embora sua cor se intensifique e se torne roxa, pode cristalizar em um sólido volátil.
 Frasco com bromo líquido puro. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]
Frasco com bromo líquido puro. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] O Bromo foi descoberto, independentemente, em 1825 por Carl Löwig, que estudou sob a direção do químico alemão Leopold Gmelin; E em 1826, pelo químico francês Antoine-Jerome Ballard. No entanto, a publicação dos resultados experimentais de Balard precedeu o de Löwig.
Bromo é o 62º elemento mais abundante da Terra, sendo distribuído em baixas concentrações pelo córtex da Terra. No mar, a concentração média é de 65 ppm. O corpo humano contém um bromo de 0,0004 %, sem saber definitivamente sua função.
Esse elemento é explorado comercialmente nas Salmuelas ou em lugares que, por condições especiais, são sais altos; Por exemplo, o Mar Morto, para o qual as águas dos territórios vizinhos, saturados com sais convergem.
É um elemento corrosivo capaz de atacar metais, como platina e paládio. Dissolvido em água, o bromo também pode exercer sua ação corrosiva nos tecidos humanos, agravando a situação porque o ácido bromidérico pode ser gerado. Em relação à sua toxicidade, pode causar danos importantes aos órgãos, como fígado, rins, pulmão e estômago.
O bromo é muito prejudicial na atmosfera, sendo 40-100 vezes mais destrutiva para a camada de ozônio que o cloro. Metade da perda da camada de ozônio na Antártica é produzida por reações relacionadas ao bromometil, composto usado como fumigante.
Possui numerosos usos, como: retardador de incêndio, agente de branqueamento, desinfetante de superfície, aditivo de combustível, intermediário na fabricação sedativa, na fabricação de produtos químicos orgânicos, etc.
[TOC]
História
Trabalho de Carl Löwig
O Bromo foi descoberto de forma independente e quase simultaneamente por Carl Jacob Löwig, um químico alemão em 1825, e por Antoine Balard, um químico francês em 1826.
Carl Löwig, um discípulo do químico alemão Leopold Gmelin, coletou água de uma mola de Bad Kreuznach e acrescentou cloro; Após a adição do éter, ele agitou a mistura de líquidos.
Então, o éter separado por destilação e concentrou -o por evaporação. Como resultado, ele obteve uma substância marrom avermelhada, que era o bromo.
Trabalho de Antoine Balard
Balard, por outro lado, usou cinzas de uma alga marrom. Assim, o bromo liberado, o cloro passou pelo material aquoso sujeito a extração, no qual o brometo de magnésio, MGBR estava presente2.
Posteriormente, o material foi destilado na presença de dióxido de manganês e ácido sulfúrico, produzindo vapores vermelhos que se condensavam em um líquido escuro. Balard achou que era um novo elemento e o chamou de muride, derivado da palavra latina Muria, com a qual a salmoura foi designada.
Pode servir a você: Matéria Viva: Conceito, Características e ExemplosFoi apontado que Balard mudou o nome de Muride para Brôme por sugestão de Anglada ou Gay-Lussac, com base no fato de que Brôme significa Pestilent, que define o cheiro do elemento descoberto.
Os resultados foram publicados por Belard em Annales de Chemie and Physique, antes de Löwig publicar seu próprio.
Somente a partir de 1858, o bromo foi produzido em quantidades importantes; ano em que os depósitos de sal de StaSfurt foram descobertos e explorados, obtendo bromo.
Estrutura e configuração eletrônica de bromo
Molécula
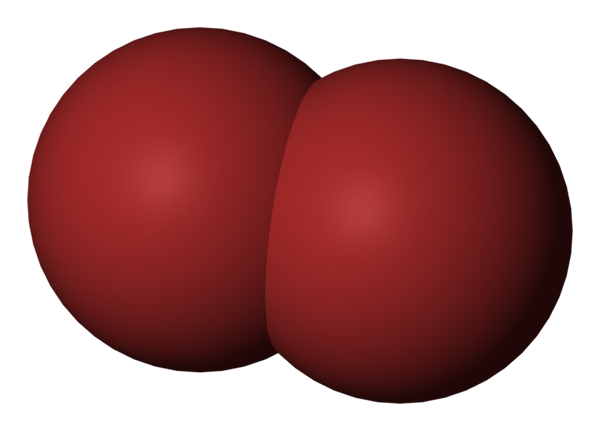 Molécula de Br2. Fonte: Benjah-BMM27 [Domínio Público].
Molécula de Br2. Fonte: Benjah-BMM27 [Domínio Público]. Na imagem superior, a molécula de bromo é mostrada, BR2, Com um modelo de preenchimento compacto. Na verdade, existe uma ligação covalente simples entre os dois átomos de bromo, BR-BR-BR-BR-BR-brid.
Sendo uma molécula diatômica e homogênea, falta momento de dipolo permanente e só pode interagir com outros do mesmo tipo através das forças de dispersão de Londres.
Esta é a razão pela qual seu líquido avermelhado está fumando; Nas moléculas BR2, Enquanto são relativamente pesados, suas forças intermoleculares os mantêm fracamente ligados.
O Bromo é menos eletronegativo que o cloro e, portanto, exerce um efeito de atração mais baixo nos elétrons das camadas de Valência. Como resultado, requer menos energia para viajar níveis mais altos de energia, absorver fótons verdes e refletir uma cor avermelhada.
Cristais
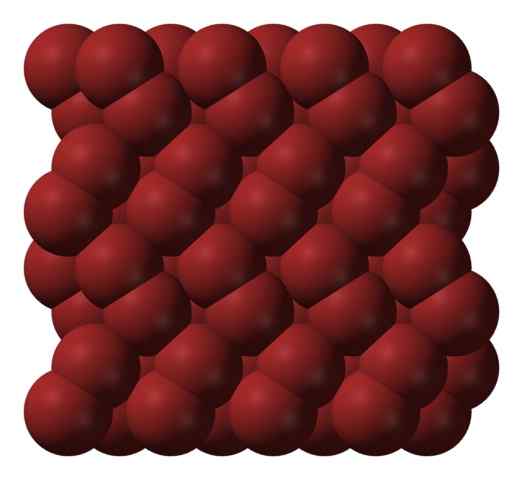 Estrutura cristalina de bromo. Fonte: Ben Mills [domínio público].
Estrutura cristalina de bromo. Fonte: Ben Mills [domínio público]. Em uma fase gasosa, moléculas BR2 Eles se separam consideravelmente até que haja interações eficientes entre eles. No entanto, abaixo do seu ponto de fusão, o bromo pode ser congelado em cristais ortorrôrômicos avermelhados (imagem superior).
Observe como as moléculas BR2 Eles estão posicionados em ordem de tal maneira que parecem "vermes de bromo". Aqui e nessas temperaturas (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Camada de Valência e estados de oxidação
A configuração eletrônica de bromo é:
[AR] 3D104s2 4p5
Sendo 3D104s2 4p5 sua camada de valência (embora o orbital 3D10 Não tem destaque em suas reações químicas). Os elétrons dos orbitais 4s e 4p são os mais externos e adicionam um total de 7, apenas um elétron para completar o octeto de Valencia.
A partir desta configuração, os possíveis estados de oxidação podem ser deduzidos para o bromo: -1, se um elétron ganha para ser isoletônico ao Kripton; +1, sendo como 3D104s2 4p4; +3, +4 e +5, perdendo todos os elétrons do orbital 4p ([AR] 3D104s24p0); e +7, executando sem elétrons no 4S orbital ([AR] 3D104s04p0).
Propriedades
Aspecto físico
Pequeno líquido marrom -avermelhado marrom escuro. É encontrado na natureza como uma molécula diatômica, com átomos unidos por uma ligação covalente. Bromo é um líquido mais denso que a água e afunda nele.
Pode atendê -lo: rádio: estrutura, propriedades, usos, obtençãoPeso atômico
79.904 g/mol.
Número atômico
35.
Cheiro
Uma fumaça de hectare, sufocante e irritante.
Ponto de fusão
-7.2 ºC.
Ponto de ebulição
58,8 ºC.
Densidade (Br2) líquido
3.1028 g/cm3
Solubilidade em água
33,6 g/l a 25 ° C. A solubilidade do bromo na água é baixa e tende a aumentar a diminuição da temperatura; comportamento semelhante a outros gases.
Solubilidades
Livremente solúvel em álcool, éter, clorofórmio, tetracloreto de carbono, dissulfeto de carbono e ácido clorídrico concentrado. Solúvel em solventes não polares e alguns polares como álcool, ácido sulfúrico e em muitos solventes halogenados.
Ponto Triplo
265,9 K a 5,8 kPa.
Ponto crítico
588 K a 10,34 MPA.
Calor de fusão (BR2)
10.571 kJ/mol.
Calor de vaporização (BR2)
29,96 kJ/mol/mol.
Capacidade calórica molar (BR2)
75,69 KJ/mol/mol.
Pressão de vapor
A uma temperatura de 270 K, 10 kPa.
Temperatura de auto -ignição
Não inflamável.
ponto de ignição
113 ºC.
Temperatura de armazenamento
2 a 8 ºC.
Tensão superficial
40,9 mn/m a 25 ºC.
Limiar de cheiro
0,05 - 3,5 ppm. 0,39 mg/m3
Índice de refração (ηd)
1.6083 a 20 ºC e 1.6478 a 25 ºC.
Eletro-negatividade
2,96 na escala Pauling.
Energia de ionização
- Primeiro nível: 1.139,9 KJ/mol.
- Segundo nível: 2.103 kJ/mol.
- Terceiro nível: 3.470 kJ/mol.
Rádio atômico
120 pm.
Rádio covalente
120.3 pm.
Van der Waals Radio
185.
Reatividade
É menos reativo que o cloro, mas mais reativo que o iodo. É um oxidante menos forte que o cloro e mais forte que o iodo. Também é um agente redutor mais fraco que o iodo, mas mais forte que o cloro.
O vapor de cloro é altamente corrosivo para muitos materiais e tecidos humanos. Ele ataca muitos elementos metálicos, incluindo platina e paládio; Mas não atacam chumbo, níquel, magnésio, ferro, zinco e menos de 300 ºC para o sódio.
Bromo na água experimenta uma mudança e se transforma em brometo. Também pode existir como um bromato (mano3-), Dependendo do pH líquido.
Devido à sua ação oxidante, o bromo pode induzir a liberação de radicais sem oxigênio. Estes são oxidantes fortes e podem causar danos nos tecidos. Além disso, o bromo pode produzir ignição espontânea quando combinada com potássio, fósforo ou lata.
Formulários
Aditivo a gasolina
A dibromida de etileno foi usada para eliminar possíveis depósitos de chumbo em motores de carros. Após a combustão da gasolina, que usava chumbo como aditivo, o bromo combinado com o chumbo para formar brometo de chumbo, um gás volátil que foi expulso pelo tubo de escape.
Enquanto o bromo eliminou a liderança da gasolina, sua ação destrutiva na camada de ozônio era muito poderosa, e é por isso que foi descartada para esta aplicação.
Pesticidas
O metileno ou brometil brometo foi usado como um pesticida para purificar os solos, especialmente para eliminar nematóides parasitas, como o Anylostome.
No entanto, o uso da maioria dos compostos contendo bromo foi descartado, novamente, destrutivo na camada de ozônio.
Controle de emissão de mercúrio
O Bromo é usado em algumas plantas para reduzir a emissão de mercúrio, metal muito tóxico.
Pode servir a você: gravimetria: análise gravimétrica, métodos, usos e exemplosFotografia
O brometo de prata, além de yoduro e cloreto de prata, é usado como um composto sensível à luz em emulsões fotográficas.
Ações terapêuticas
O brometo de potássio, assim como o brometo de lítio, foi usado como sedativos gerais no século XIX e o início do século XX. Sais simples ainda são usados em alguns países, como anticonvulsões.
No entanto, o FDA dos Estados Unidos não aprova o uso de bromo para o tratamento de qualquer doença hoje.
Retardador de incêndio
O bromo é transformado pelas chamas em ácido bromórico, que interfere na reação de oxidação que ocorre durante o incêndio e produz sua extinção. Os polímeros contêm bromo são usados para fazer resinas de retardamento de fogo.
Aditivo alimentar
Rastreios de bromato de potássio para farinha foram adicionados para melhorar sua cozinha.
Reagentes químicos e intermediários
O brometo de hidrogênio é usado como agente redutor e catalisador para reações orgânicas. O Bromo é usado como um intermediário químico na fabricação de medicamentos, fluidos hidráulicos, agentes de refrigerante, desumidificadores e em preparações para ondular o cabelo.
Ele também encontra uso na elaboração de fluidos de perfuração de poços, produtos para desinfecção da água, agentes esbranquiçados, desinfetantes de superfície, corantes, aditivos de combustível, etc.
Ação biológica
Um estudo realizado em 2014 indica que o bromo é um cofator necessário para a biossíntese do colágeno IV, o que faz do bromo um elemento essencial para o desenvolvimento do tecido animal. No entanto, não há informações sobre as consequências de um déficit do elemento.
Onde está
O Bromo é extraído comercialmente de minas salgadas e poços de Salmuelas profundos encontrados no estado do Arkansas, e no grande lago salgado de Utah, ambos nos Estados Unidos. Esta última salmoura tem uma concentração de bromo a 0,5 %.
Para extrair bromo.
O Mar Morto, na fronteira entre a Jordânia e Israel, é um mar fechado que está sob o nível do mar, o que a torna uma concentração muito alta de sais.
Bromo e Potassa são obtidos comercialmente lá, por evaporação de água com um alto sal do Mar Morto. Neste mar, a concentração de bromo pode atingir 5 g/l.
Também é encontrado em altas concentrações em algumas fontes termais. O Bominita, por exemplo, é um mineral de brometo de prata encontrado na Bolívia e no México.
Riscos
O bromo em estado líquido é corrosivo para tecidos humanos. Mas o maior perigo para o homem vem de vapores de bromo e inalação.
Respire um ambiente com uma concentração de bromo de 11-23 mg/m3 Produz choques graves. Uma concentração de 30-60 mg/m3 É extremamente prejudicial. Enquanto isso, uma concentração de 200 mg pode ser fatal.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Bromo. Banco de dados PubChem. CID = 23968. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Ross Rachel. (8 de fevereiro de 2017). Fatos sobre bromo. Recuperado de: LiveScience.com
- Wikipedia. (2019). Bórax. Recuperado de: em.Wikipedia.org
- Lentech b. V. (2019). Bromo. Recuperado de: lentech.com
- « Características, estrutura, tipos e função da miosina
- Características, estrutura, tipos e funções nucleas »

