Características, estrutura, tipos e função da miosina
- 1769
- 488
- Ernesto Bruen
O Miosina É um motor molecular, da natureza da proteína, capaz de se mover em filamentos de actina no citosol. A energia que impulsiona o deslocamento da miosina vem da hidrólise ATP. Por causa disso, a miosina é geralmente definida como uma enzima mecanoquímica.
Nos eucariotos, a miosina é uma proteína muito abundante. Existem diferentes tipos de miosina, que são codificados por uma família de genes. Em leveduras, 5 classes são distinguidas, enquanto dezenas foram descritas em mamíferos.
 Fonte: David Richfield (Usuário: Slashme) Ao usar esta imagem em obras externas, ela pode ser citada da seguinte maneira: Richfield, David (2014). "Galeria médica de David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]
Fonte: David Richfield (Usuário: Slashme) Ao usar esta imagem em obras externas, ela pode ser citada da seguinte maneira: Richfield, David (2014). "Galeria médica de David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]] A miosina tem uma grande variedade de funções. Miosina I, ao lado de Actin, participa do movimento de queratócitos.
A miosina II fornece rigidez à membrana plasmática, participa da citocinese e da contração muscular. Ambas, Myosinas I e II, colaboram com a migração celular. Myosinas I e V realizam o transporte de vesículas ao longo dos filamentos de actina.
[TOC]
Estrutura
Nas micrografias eletrônicas, a estrutura típica de isoforma de miosina tem três domínios: cabeça, pescoço e cauda. Através da hidrólise com quimotripsina, é obtido um segmento que consiste em cabeça e pescoço, chamada meromiosina pesada (HMM) e um segmento de cauda, chamado meomiosina leve (LMM).
O domínio da cabeça é o extremo N-terminal da cadeia pesada, e o domínio da cauda é o extremo C-terminal da cadeia leve.
As classes de miosina podem ser diferenciadas pelo número de cadeias polipepticas que a compõem, e a abundância e a classe de cadeia leve unida ao redor.
Miosina I tem uma cadeia de polipeptídeos, que forma uma cabeça e sua cauda não possui regiões helicidas alfa. Enquanto as myosinas i e v têm duas cadeias polipeptídicas, e lá.
Myosinas I e V têm sites de sindicatos para calmodulina, que regula e corrige CA+2, Em correntes leves. A Myosina que eu consertei CA+2 Nas correntes leves, mas isso é diferente de calmodulina.
Caracteristicas
No nível mecânico, as myosinas têm três características, a saber:
- A cabeça da miosina é o domínio motor que avança por etapas discretas: a união da miosina vá para um filamento de actina, sua inclinação e separação subsequente produzem o movimento da miosina. Este processo é cíclico e depende do ATP.
- Alterações de conformação: A hidrólise de uma molécula ATP é acoplada em cada etapa de uma molécula de miosina, por meio de níveis de amplificação e transmissão. Isso implica grandes mudanças conformacionais de miosina.
Pode atendê -lo: simetria radialO primeiro nível de amplificação é produzido pela perda do grupo gama-fosfato do ATP, o que permite uma reorganização dos elementos estruturais no local da União ATP. Esta reorganização é coordenada com mudanças estruturais no local da união para actina.
O segundo nível de amplificação implica a comunicação da mudança conformacional no local ativo para os componentes estruturais do terminal carboxil.
- Direcionalidade: Verificou -se que o meu tem polaridade ou direcionalidade reversa, no final (+) do filamento de actina. Esta conclusão vem dos experimentos de nivelamento do filamento de actina, usando o microscópio óptico de fluorescência.
Funções
A miosina, ao lado da actina, participa de contração muscular, adesão celular, citocinese, concedendo rigidez às membranas corticais e deslocamento de algumas vesículas, entre outras funções.
Defeitos de miosina podem produzir condições patológicas. Por exemplo, defeitos nas myosinas I e V estão relacionados, respectivamente, com miopatias de miosina e distúrbios de pigmentação (síndrome de Griselli). Enquanto os distúrbios das isoformas da miosina VI causam perda do ouvido.
Contração muscular
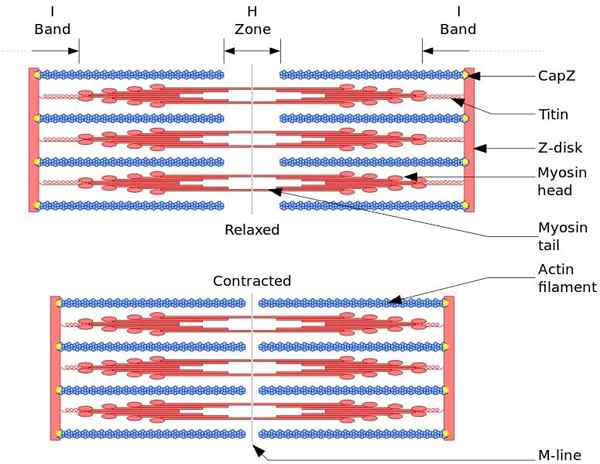
A unidade funcional e estrutural do músculo esquelético é sarcomro. Durante a contração muscular, o comprimento do sarcomer atinge 30% de seu comprimento original.
Os sarcômeros são compostos de espessura, miosina e filamentos finos de actina, que são organizados de uma maneira complexa. Em geral, as cabeças de miosina estão localizadas nas extremidades distais do filamento e suas caudas em direção ao centro do sarcômero, e a organização é bipolar.
Para fazer a contração muscular, as cabeças da miosina, das extremidades opostas, devem se mover para o disco Z ou o fim (+) do filamento. Como a organização de filamentos grossos é bipolar, ocorre o deslizamento de filamentos finos em filamentos grossos, acionados por ATP.
A força de deslocamento ocorre porque centenas de cabeças de miosina, de um filamento grosso, interagem com um filamento fino.
Citocinese
Durante a mitose, quando os microtúbulos dos pólos do eixo são separados, a actina e a miosina II formam um anel contrátil na célula da célula. Este anel contrai seu diâmetro e dividindo a célula em duas partes.
Concessão de rigidez às membranas corticais
Nas células mutantes que não possuem miosina II, a membrana plasmática é facilmente se deforma quando uma força externa é aplicada. Isso acontece porque a miosina II fornece força de agregação para as proteínas da membrana plasmática.
Pode atendê -lo: adaptação morfológicaAdesão celular
No tecido epitelial, a actina contrátil e as vigas da miosina II estão localizadas nos bairros da membrana plasmática e formam uma correia circular que circunda a superfície celular celular. Esta correia circular determina a forma da célula e mantém a união entre as células.
O contato entre as células ocorre pela união da correia circular para moléculas de adesão celular, usando proteínas de ligação.
Deslocamento de algumas vesículas
Evidências experimentais revelam que a miosina V realiza transporte de membrana do aparelho de Golgi para a periferia da célula. Algumas evidências são:
- Nas células de tecido nervoso, por imunofluorescência de astrócitos, verificou -se que a miosina V está localizada ao lado de Golgi.
- Em leveduras, mutações no gene miosina V interrompem a secreção de proteínas e, consequentemente, as proteínas se acumulam em citosol.
- A miosina I isoformas é responsável pelo transporte de vácobas para a membrana celular. Usando anticorpos específicos contra isoformas da miosina I, verificou -se que essas isoformas estão localizadas em diferentes partes da célula.
Por exemplo, quando uma ameba viva é marcada com um anticorpo contra a miosina ic, o transporte do vacúolo para a membrana é preso. Por causa disso, o vacúolo se expande e a célula explode.
Doenças relacionadas à miosina
Myosinas e perda de ouvido
Existem numerosos genes e mutações que produzem a perda de ouvido. Esta doença é frequentemente monogenética .
Mutações em miasinas não convencionais, com uma ou duas cabeças de miosina, afetam o funcionamento do ouvido interno. Algumas das miosina mutadas são miosina IIIa, miosina viia e miosina xva. Recentemente, duas mutações foram descobertas na miosina VI.
As mutações na miosina VI são C.897G> T e P.926Q. A primeira mutação afeta uma região que interage com o ativo localizado, chamado Switch I. Homozigoto para mutação exposição antecipada O fenótipo, causando efeitos graves.
A segunda mutação afeta uma região de carga com carga, em uma hélice alfa na cauda da miosina VI. Esta região é importante para a dimerização proximal do motor e afeta a função estéreo-parcê da miosina VI.
Pode atendê -lo: ciências auxiliares da biologiaOutra mutação é P.ASN207Ser, que produz um motor incapaz de produzir força. Isso ocorre porque o ASN 207 é um resíduo de aminoácidos do local ativo, cuja função é a união e a hidrólise do ATP.
A mutação p.Arg657trp produz a perda da função da miosina VI. O resíduo Arg está envolvido nas mudanças conformacionais que ligam a hidrólise ao movimento da miosina.
Miosina x e câncer
Myosina X (Myo10) é uma miosina não convencional que é expressa no cérebro, endotélios e muitos epitélios. MYO10 e três tipos de projeções baseadas em actina (filópodes, invólucros e projeções semelhantes aos filópodes) trabalham durante a metástase do câncer.
As células cancerígenas invasivas têm um grande número de filópodes e expressam altos níveis de fascina. Esta proteína realiza cruzamentos entre filamentos de actina. Para escapar do tumor primário, os invasores são formados, ricos em atividade proteolítica, que digerem a matriz extracelular circundante.
Uma vez que as células atingem a matriz extracelular, as projeções semelhantes aos filópodes ajudam a dispersar e colonizar. Altos níveis de MYO10 indicam alta agressividade e metástase no câncer de mama.
O silenciamento de Myox produz perda do caráter metastático das células, que não conseguem formar projeções baseadas em actina. Todas essas projeções têm aderências baseadas em abrangentes, que são transportadas pelo My1010 dentro do Philopodium.
Myox está envolvido na formação dos centros. A ausência de Myox favorece a formação de picos multipolares. Myox também está envolvido na sinalização em células cancerígenas. Por exemplo, a MYOX é ativada por 3,4,5, -Inositol trifosfato (PIP3).
Referências
- Alberts, b., Johnson, a., Lewis, J., e repolho. 2007. Biologia da célula molecular. Garland Science, Nova York.
- Brownstein, Z., Abu-rayyan, a., Karfunkel-Don, d., Sirigu, s., Davido, b., Shohat, m., Frydman, m., Houdusse, a., Kanaan, m., Avraham, k. 2014. Novas mutações na miosina para perda auditiva hereditária Revelado pela captura genômica direcionada e sequenciamento massivamente paralelo. European Journal of Human Genetics, 22: 768 -775.
- Courson, d.S. e Cheney, r.E. 2015. Miosina-X e doença. Experimental Cell Research, 334: 10-15.
- Lodish, h., Berk, a., Zipurski, s.eu., Matsudaria, p., Baltimore, d., Darnell, J. 2003. Biologia celular e molecular. Medica editorial Panamericana, Buenos Aires, Bogotá, Caracas, Madri, México, Sāo Paulo.
- Schliwa, m. e woehlke, g. 2003. Motores moleculares. Nature, 422: 759 - 765.
- Para valer.D. 2003. A caixa de ferramentas molecular para transporte intacelular. Cell, 112: 467-480.
- « Características, estrutura e funções da exonuclease
- História do Bromo, estrutura, configuração eletrônica, propriedades, usa »

